近日����,我國原研阿爾茨海默病藥物甘露特鈉膠囊(“九期一”)國際多中心ⅲ期臨床試驗取得新進展���,首都醫(yī)科大學宣武醫(yī)院和上海市精神衛(wèi)生中心分別隨機入組一名受試者,完成這項臨床試驗在中國的首例患者給藥���。整個項目采用隨機雙盲試驗方法��,歷時52周�,將在2025年全部完成�����。此后���,綠谷制藥計劃開展歐美地區(qū)的新藥注冊上市工作����,為更多阿爾茨海默病患者帶來新的希望。
甘露特鈉膠囊是中國科學院上海藥物研究所等單位歷時22年研發(fā)成功的阿爾茨海默病原創(chuàng)新藥����,也是全球靶向“腦腸軸”機制的阿爾茨海默病藥物。2019年11月����,這款新藥通過優(yōu)先審評審批程序獲國家藥監(jiān)局批準上市�����,用于輕度至中度阿爾茨海默病�,改善患者認知功能,填補了全球這一領域17年無新藥上市的空白�。
甘露特鈉膠囊藥盒樣品及膠囊樣品
研究顯示,這種以海洋褐藻提取物為原料的低分子酸性寡糖化合物���,能通過調(diào)節(jié)腸道菌群減少菌群異常代謝產(chǎn)物�,從而減輕腦內(nèi)神經(jīng)炎癥����。研究還顯示,這種寡糖化合物能直接與人體內(nèi)的β-淀粉樣蛋白結合��,并減少β-淀粉樣蛋白在腦中的沉積。
長期以來����,科學界認為阿爾茨海默病的病因只存在于人腦,但中科院上海藥物所研究員耿美玉領導的團隊發(fā)現(xiàn)了這種疾病的“腦腸軸”機制——包括神經(jīng)內(nèi)分泌失調(diào)�、促炎癥、代謝紊亂����、腸道菌群失調(diào)在內(nèi)的系統(tǒng)性損傷貫穿阿爾茨海默病的整個病程,并且在腦結構損傷出現(xiàn)前就觀察到這些系統(tǒng)性損傷�����。這意味著��,阿爾茨海默病的初觸發(fā)因素可能始于外周神經(jīng)系統(tǒng)�。
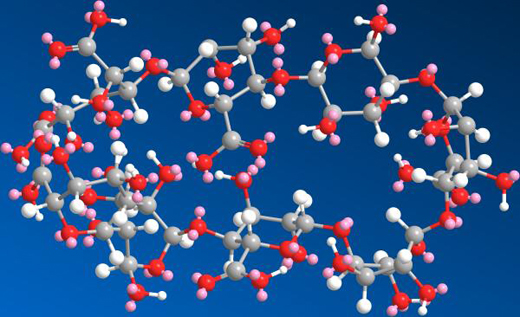
甘露特鈉的化學結構式
7月舉行的2021阿爾茨海默病協(xié)會國際會議上,耿美玉做了《阿爾茨海默病連續(xù)病程中的系統(tǒng)性損傷的全景特征》報告���,提出要以整體觀視角����,將認知測試、神經(jīng)成像等臨床評估與血液變化��、微生物變化等系統(tǒng)性損傷聯(lián)系起來進行研究�。這個觀點得到很多專家的認同。內(nèi)華達大學拉斯維加斯分校腦科學教授杰弗里·庫明斯說:“如今有越來越多的研究發(fā)現(xiàn)����,腸道微生物組與神經(jīng)退行性疾病存在關聯(lián)。比如在帕金森病中�����,腸道微生物組促炎因子會改變�;在肌萎縮側索硬化癥(漸凍癥)病程中�,腸道菌群的構成也會發(fā)生變化?!?/span>
因此,綠谷制藥不僅在開展“九期一”治療阿爾茨海默病的國際多中心ⅲ期臨床試驗�,還在開展針對帕金森病的臨床前研究,計劃今年下半年提交國際多中心ⅱ期臨床試驗申請�����。血管性癡呆�����、視神經(jīng)脊髓炎、肌萎縮側索硬化癥等3個適應癥的臨床前研究也在進行中��,預計今年底遞交“九期一”治療視神經(jīng)脊髓炎臨床研究申請��。
位于上海青浦區(qū)的糖藥物生產(chǎn)基地“九期一”制劑生產(chǎn)車間
據(jù)介紹�,代號為“綠色記憶”的甘露特鈉膠囊國際多中心ⅲ期臨床試驗將在北美、歐洲和中國等14個國家和地區(qū)設立約200家臨床中心�,涉及2046名輕度至中度阿爾茨海默病患者。在雙盲期之后��,還將開展為期26周的開放試驗����。相較于已完成的國內(nèi)ⅲ期臨床試驗,國際ⅲ期臨床試驗將顯著提高中度偏重患者的比例���,在觀察指標上增加血液中免疫�����、代謝��、神經(jīng)損傷等與病程有關的生物標志物和菌群檢測����,以進一步明確甘露特鈉膠囊改變疾病進程的潛力和長期治療效果。
聲明:本文版權歸原作者所有�,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤��,或侵犯您的版權��,請聯(lián)系我們�����,我們將在及時修改或刪除內(nèi)容����,聯(lián)系郵箱:marketing@360worldcare.com