自2017年CAR-T療法上市以來�,全球已有5款CD19 CAR-T和1款BCMA CAR-T療法獲批,累計適應證包括急性淋巴細胞白血病�、彌漫性大B細胞淋巴瘤、原發(fā)縱隔B細胞淋巴瘤���、套細胞淋巴瘤����、濾泡性淋巴瘤和多發(fā)性骨髓瘤���。然而�,盡管CAR-T細胞療法已被證明是一種強大的對抗惡性血液腫瘤的武器(一些病例接受治療后保持多年無癌生存)���,但這類療法在實體瘤治療方面療效要差得多��,部分原因是CAR-T在回輸?shù)交颊唧w內(nèi)后會經(jīng)歷一種叫“耗竭(exhaustion�����,功能障礙)”的過程��。
T細胞耗竭這一現(xiàn)象被認為是進化而來�����,目的是防止這些強大的免疫細胞對身體造成過多的附帶損害�����。當T細胞暴露于靶抗原太長時間(大約幾周)���,就會觸發(fā)耗竭過程,這也是實體瘤微環(huán)境中的典型狀況�����。
12月2日,新發(fā)表在Cell雜志上的一項研究中�,來自賓夕法尼亞大學Perelman醫(yī)學院的一個科學家團隊揭示了CAR-T耗竭過程的關鍵分子機制,并指出了克服耗竭過程的潛在有效策略�����,為CAR-T治療實體瘤帶來了新的希望�����。CAR-T先驅(qū)Carl H. June教授是這篇論文的共同通訊作者之一��。
來源:Cell
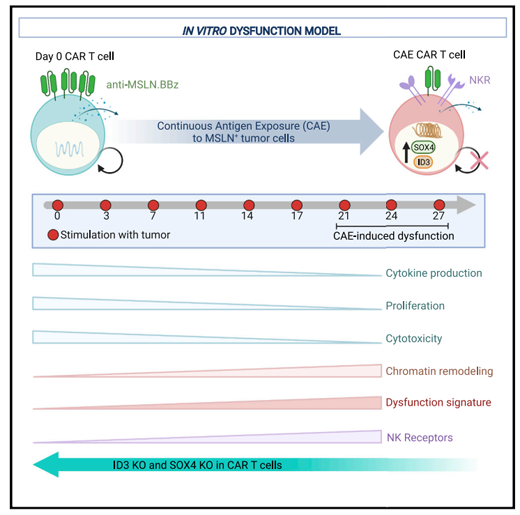
研究中����,CarlH. June教授及其同事開發(fā)了一個lab-dish模型,使他們能夠全面研究用于攻擊胰腺腫瘤的CAR-T細胞的耗竭過程���。研究發(fā)現(xiàn)��,遺傳調(diào)節(jié)因子ID3和SOX4在T細胞耗竭過程中發(fā)揮了關鍵作用�����,沉默這兩個因子大大提升了CAR-T殺傷腫瘤的效果�。
在抗原持續(xù)刺激下CD8+T細胞向NK樣T細胞轉(zhuǎn)變(來源:Cell)
具體來說����,他們設計了一款間皮素(mesothelin)靶向CAR-T細胞,并讓這種CAR-T細胞暴露于表達間皮素的胰腺腫瘤細胞4周���。分析顯示���,CAR-T細胞除了表現(xiàn)出一些典型的耗竭跡象,也有一些先前研究中未明顯展露的變化���,如一些T細胞身份發(fā)生改變:從T細胞部分轉(zhuǎn)換為NK細胞����?��?茖W家們在來自癌癥患者的耗竭CAR-T細胞中也發(fā)現(xiàn)了類似T細胞向NK細胞轉(zhuǎn)變的跡象����。
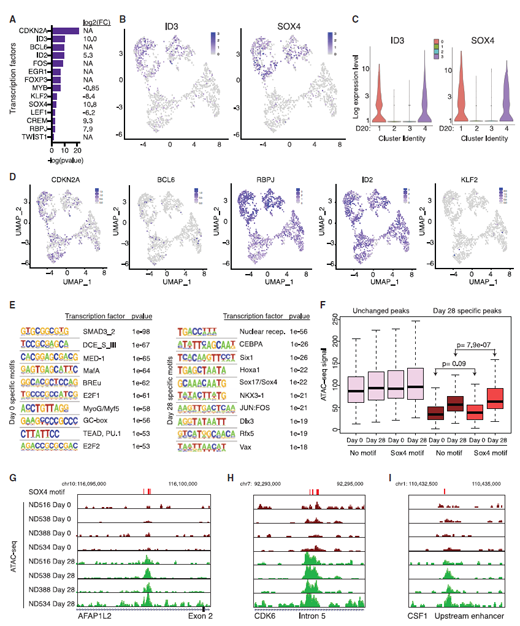
ID3和SOX4是功能障礙(耗竭)特征的潛在調(diào)節(jié)因子(來源:Cell)
更重要的是����,研究者們觀察到����,CAR-T細胞的耗竭伴隨著ID3和SOX4兩種蛋白質(zhì)的水平激增���,這兩種蛋白是免疫細胞中大量基因的主開關�。研究顯示�,沉默這些明顯的T細胞耗竭開關能夠讓耗竭的CAR-T細胞在長時間暴露于腫瘤細胞后仍然保持其腫瘤殺傷效果。這些發(fā)現(xiàn)表明����,抑制ID3和/或SOX4可能有助于CAR-T細胞更好地對抗實體腫瘤。
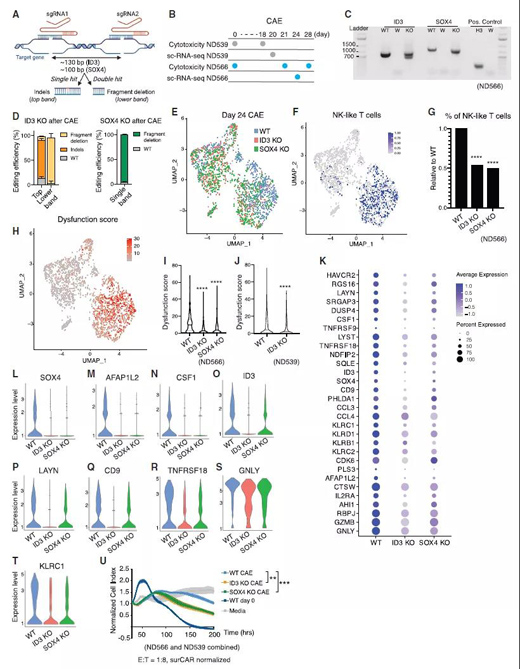
破壞ID3和SOX4改善了CAR-T的效應功能(來源:Cell)
總結(jié)來說����,這項研究揭示了人類CAR-T細胞的可塑性,并證明下調(diào)ID3和SOX4的表達可以通過預防或延遲CAR-T細胞功能障礙來提高CAR-T細胞治療實體瘤的療效���。
聲明:本文版權歸原作者所有���,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤�����,或侵犯您的版權,請聯(lián)系我們��,我們將在及時修改或刪除內(nèi)容�����,聯(lián)系郵箱:marketing@360worldcare.com