一線NSCLC!基石藥業(yè)PD-L1單抗在華獲批
12月21日����,國家藥監(jiān)局官網(wǎng)顯示基石藥業(yè)PD-L1單抗舒格利單抗上市申請(受理號:CXSS2000056)獲NMPA批準(zhǔn)。聯(lián)合化療���,一線治療晚期(IV期)鱗狀和非鱗狀非小細胞肺癌(NSCLC)患者,這是國內(nèi)獲批的第2款國產(chǎn)PD-L1單抗����。
就在今年9月2日,基石藥業(yè)在國內(nèi)遞交了舒格利單抗的第2項上市申請��。用于同步或序貫放化療后未發(fā)生疾病進展的不可切除的III期NSCLC患者鞏固治療���。舒格利單抗有望成為全球一個獲批覆蓋局部晚期/不可切除(III期)和轉(zhuǎn)移性(IV期)非小細胞肺癌的PD-1或PD-L1單抗����。
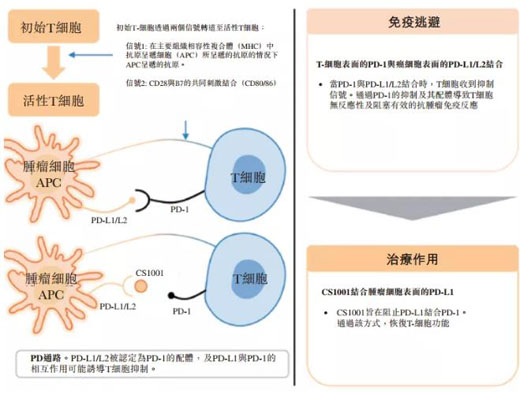
舒格利單抗是基石藥業(yè)基于從美國Ligand公司授權(quán)引進的一站式產(chǎn)生全人源抗體的OmniRat®轉(zhuǎn)基因動物平臺開發(fā)的PD-L1單克隆抗體。作為一種全人源全長PD-L1單克隆抗體�����,舒格利單抗是一種接近人體的天然G型免疫球蛋白4(IgG4)單抗藥物�����。較大限度地減少抗藥抗體(ADA)的產(chǎn)生��;保留抗體依賴性細胞介導(dǎo)的吞噬作用( ADCP)活性以提高療效�����。
舒格利單抗作用機制
代號為CS1001-302的III期臨床研究評估了舒格利單抗聯(lián)合化療在未經(jīng)一線治療的��、IV期NSCLC患者中的有效性和安全性����。該項臨床試驗在計劃的期中分析中,經(jīng)獨立數(shù)據(jù)監(jiān)查委員會(iDMC)評估達到了預(yù)設(shè)的主要研究終點�����,即與安慰劑聯(lián)合化療相比,舒格利單抗聯(lián)合化療顯著延長了無進展生存期(PFS)�����,將疾病進展或死亡風(fēng)險降低50%�����。
亞組分析顯示�����,鱗狀與非鱗狀NSCLC的患者����、PD-L1表達>=1% 與 PD-L1表達<1%的患者均顯示出臨床獲益?����?偵嫫冢∣S)數(shù)據(jù)尚未成熟��,但可觀察到獲益趨勢(mOS: 未達到 vs 14.75 月, HR=0.66 [95% CI: 0.44�,0.97])。舒格利單抗聯(lián)合化療的安全性良好�����,未發(fā)現(xiàn)新的安全性信號��。
2021年7月��,GEMSTONE-302研究的PFS分析結(jié)果顯示�����,舒格利單抗聯(lián)合化療進一步增強了主要療效終點無進展生存期獲益�,患者疾病進展或死亡風(fēng)險降低52%,并顯示出總生存期明顯獲益的趨勢�,2年生存率為47.1%。
目前�����,舒格利單抗已進行多項注冊性臨床試驗����,包括一項針對淋巴瘤的II期注冊臨床試驗 (CS1001-201),以及四項分別在III期�、IV期非小細胞肺癌�、胃癌和食管癌的III期注冊臨床試驗���。舒格利單抗曾被美國FDA授予治療T細胞淋巴瘤的孤兒藥資格 (ODD) 和用于治療成人R/R ENKTL(結(jié)外NK/T細胞淋巴瘤)的突破性療法認(rèn)定 (BTD)���,該項適應(yīng)癥也被中國NMPA納入“突破性治療藥物”。
2020年9月30日����,基石藥業(yè)與輝瑞達成戰(zhàn)略合作,其中包括舒格利單抗在中國大陸地區(qū)的開發(fā)和商業(yè)化���,以及關(guān)于將更多腫瘤產(chǎn)品引進大中華地區(qū)的合作框架����。
2020年11月2日�����,基石藥業(yè)與美國EQRx公司達成戰(zhàn)略合作�����,特有授權(quán)EQRx在大中華區(qū)以外地區(qū)開發(fā)及商業(yè)化舒格利單抗和CS1003(抗PD-1單抗)兩款處于后期研發(fā)階段的腫瘤免疫治療藥物���?���;帢I(yè)將與EQRx緊密合作在美國等多個國家遞交NDA��,預(yù)計在2022年提交美國BLA�。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息��,如作者信息標(biāo)記有誤����,或侵犯您的版權(quán),請聯(lián)系我們���,我們將在及時修改或刪除內(nèi)容��,聯(lián)系郵箱:marketing@360worldcare.com