胰腺癌新療法III期研究成功��,顯著延長總生存期
11月9日,Ipsen宣布�,NALIRIFOX方案(Onivyde+5-氟尿嘧啶/亞葉酸+奧沙利鉑)的III期NAPOLI 3研究達到主要終點�����,可顯著延長患者的總生存期和無進展生存期�����。
NAPOLI 3研究是一項多中心��、隨機���、開放標簽的III期臨床試驗���,共納入770例患者,旨在評估NALIRIFOX方案對比白蛋白結合型紫杉醇+吉西他濱治療先前未經(jīng)治療的轉移性胰腺導管腺癌(mPDAC)患者的療效和安全性����。研究的主要終點為總生存期,次要終點包括無進展生存期和客觀緩解率����。
胰腺癌是惡性腫瘤中的“癌癥之王”,其中PDAC是常見的一種類型����。據(jù)統(tǒng)計,全球每年近50萬例PDAC確診病例���,在美國這一數(shù)字約為6萬例�。該疾病在早期階段無特定癥狀����,通常在疾病擴散到身體其他部位(轉移性或IV期)之后才被確診���。目前,只有不到20%的PDAC患者的生存期超過1年����。總體而言����,在全球和美國所有癌癥類型中,胰腺癌的5年存活率較低����。
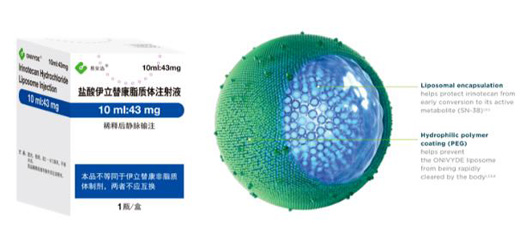
Onivyde(伊立替康脂質體注射液)早由Hermes BioSciences開發(fā),后來其權益在智擎生技����、Merrimack Pharmaceuticals、Baxter(Shire子公司)����、Ipsen和施維雅中多次轉手?����?偟膩碚f,目前Onivyde的權益歸屬為:Ipsen(美國)��,施維雅(除了美國和中國臺灣)�,Merrimack(中國臺灣)��。
Onivyde是一種長效循環(huán)的拓撲異構酶I抑制劑����,旨在干擾癌細胞的DNA復制過程。脂質體可以避免伊立替康在體內過早轉化為活性代謝物SN-38���,有助于伊立替康在體循環(huán)中保持更長的半衰期��,增加藥物在腫瘤內的沉積和接觸�,增強抑制腫瘤生長的效果����。
2015年10月,Onivyde首次獲批上市�,用于與5-氟尿嘧啶(5-FU)和亞葉酸(LV)聯(lián)用治療接受吉西他濱治療后進展的轉移性胰腺癌患者。但Onivyde不可作為單一藥物用于治療轉移性胰腺癌患者��。今年4月,Onivyde在國內獲批上市���,商品名為易安達�。
除了胰腺癌以外�����,Ipsen和施維雅還開展了Onivyde針對小細胞肺癌(SCLC)���、胃癌�����、結直腸癌��、食管癌等腫瘤適應癥的臨床研究���。2020年11月,Onivyde獲FDA快速通道資格��,適應癥為二線單藥治療接受鉑類化療期間或之后進展的SCLC患者�。遺憾的是,今年8月,Ipsen宣布Onivyde二線單藥治療SCLC的III期RESILIENT研究失敗�����。
除Onivyde外��,還有8款在研伊立替康改良型制劑��。其中����,HR070803���、LY01610��、伊立替康脂質體和JZC23為伊立替康脂質體注射液��,CM-BC2為伊立替康藥物洗脫珠�,LY01616為伊立替康氟尿苷脂質體�,Oncoral為伊立替康腸溶片,Orotecan為伊立替康口服溶液��。
恒瑞開發(fā)的HR070803已于今年4月在國內申報上市����,用于聯(lián)合5-FU/LV二線治療經(jīng)吉西他濱治療失敗后的局部晚期或轉移性胰腺癌患者��。
聲明:本文版權歸原作者所有�����,轉載文章僅為傳播更多信息����,如作者信息標記有誤���,或侵犯您的版權��,請聯(lián)系我們��,我們將在及時修改或刪除內容���,聯(lián)系郵箱:marketing@360worldcare.com