Nature:一種基于CRISPR/Cas9的非病毒精準基因組編輯臨床級療法
近幾年�,CRISPR基因編輯系統(tǒng)在癌癥治療領(lǐng)域被廣泛探索,它可以精準編輯患者特定基因���,并與腺病毒載體(AAV)結(jié)合,快速有效地激活免疫系統(tǒng)�,以對癌細胞發(fā)起攻擊。然而�,由于個體間存在差異,導(dǎo)致現(xiàn)有療法很難在大部分患者群體中取得良好的效果���。
通常情況下�,每個人的免疫細胞T細胞表面都有特異性受體(TCR)�,可以特異性識別癌細胞突變。為此��,科學(xué)家們假設(shè)���,如果能將患者T細胞受體分離出來�,在經(jīng)基因編輯后再重新輸入到免疫細胞中�����,或許可以產(chǎn)生個性化且有效的細胞療法�����。
近期,發(fā)表在《Nature》上一篇新研究中����,來自加州大學(xué)洛杉磯分校等多機構(gòu)的研究團隊首次開發(fā)了一種基于CRISPR/Cas9的非病毒精準基因組編輯的臨床級療法����,可以有效重定向免疫細胞以識別自身癌細胞中的突變。在首次人體臨床試驗中���,該療法取得良好的效果�。該研究證明了非病毒精確基因組工程用于制造臨床級基因工程過繼細胞轉(zhuǎn)移療法的可行性和安全性���。
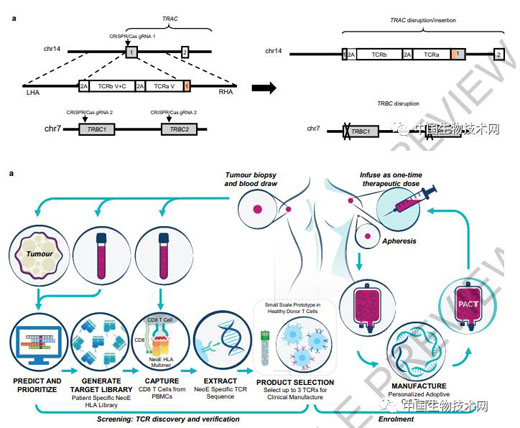
在這項新研究中�,該團隊開發(fā)了一種一種基于CRISPR/Cas9非病毒精確基因組編輯的臨床級方法���。該方法同時敲除兩個內(nèi)源性TCR基因TCRα(TRAC)和TCRβ(TRBC)��,并在TRAC位點插入新抗原特異性TCR(neoTCR)的兩條鏈�����。然后���,利用了一系列技術(shù)來有效定義T細胞對超過60個人類白細胞抗原(HLA)I類等位基因突變的新抗原反應(yīng)�。
在首次人體1期臨床試驗中��,他們治療了16名患有各種難治性實體瘤患者�,包括結(jié)腸癌、乳腺癌和肺癌�����。從患者血液中分離出T細胞受體(TCR)與個性化可溶性預(yù)測新抗原-HLA捕獲試劑結(jié)合顯示����,患者自身癌癥有多達350個突變,超過5000個突變靶向34種HLA亞型���。
然后��,研究人員對免疫細胞特異性識別癌癥突變的TCR基因進行測序����,發(fā)現(xiàn)共有175個新分離的neoTCR�。他們通過一步式CRISPR編輯,敲除現(xiàn)有的TCR���,并將經(jīng)基因編輯的neoTCR敲入患者自身的免疫細胞中�����,以重新引導(dǎo)免疫細胞特異性識別癌癥中的突變��。
16名患者接受了三種不同的基因工程細胞產(chǎn)品����,每種都表達患者特異性的neoTCR�。治療期間,所有人都出現(xiàn)了化療的預(yù)期副作用�,其中一名患者出現(xiàn)了1級細胞因子釋放綜合征;另一名患者出現(xiàn)了3級腦炎�。,5名患者病情穩(wěn)定��,其余11名患者的疾病進展為較佳治療反應(yīng)�����。
研究人員在輸注后的腫瘤活檢中檢測到經(jīng)基因編輯的NeoTCR T細胞����,其頻率要高于輸注前的天然TCR�����。
總之����,這項研究證明了這種新方法的可行性�����,包括分離和克隆多個識別癌細胞突變的免疫細胞受體�����、使用一步式非病毒精確基因組編輯同時敲除內(nèi)源性免疫細胞受體并敲入重定向受體�、制造臨床級TCR工程T細胞。此外�,該研究還證明了輸注三種基因編輯的新TCR T細胞的安全性,以及基因工程T細胞遞送到腫瘤的能力����。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息����,如作者信息標記有誤����,或侵犯您的版權(quán)��,請聯(lián)系我們�����,我們將在及時修改或刪除內(nèi)容�����,聯(lián)系郵箱:marketing@360worldcare.com