阿爾茨海默病療法「侖卡奈單抗」在中國申報上市
今日(12月22日),中國國家藥品監(jiān)督管理局藥品審評中心(CDE)官網(wǎng)新公示�,衛(wèi)材(Eisai)已遞交1類新藥侖卡奈單抗注射液的上市申請并獲得受理。公開資料顯示��,侖卡奈單抗(Lecanemab��,BAN2401)是治療阿爾茨海默?����。ˋD)所致輕度認知障礙(MCI)和輕度AD的抗淀粉樣蛋白(Aβ)原纖維抗體�����。
截圖來源:CDE官網(wǎng)
阿爾茨海默病是老年人中常見的神經(jīng)退行性疾病�,而淀粉樣蛋白沉積是患者大腦的標志性特征����。靶向淀粉樣蛋白是阿爾茨海默病新藥開發(fā)的重要方向之一,侖卡奈單抗也是目前管線中廣受關注的一款在研療法��,它與可溶性Aβ聚合體結合�,并且促進它們的清除,具有改變疾病病理,緩解疾病進展的潛力��。
根據(jù)衛(wèi)材早前發(fā)布的新聞稿���,侖卡奈單抗的全球開發(fā)和監(jiān)管提交由衛(wèi)材主導����,而產(chǎn)品則由衛(wèi)材和渤?���。˙iogen)共同商業(yè)化和推廣。2022年7月���,美國FDA受理了侖卡奈單抗在快速通道資格下的生物制品許可申請(BLA)�����,并授予其優(yōu)先審評資格���。PDUFA日期定于2023年1月6日。衛(wèi)材還曾在新聞稿表示���,F(xiàn)DA已同意Clarity AD研究的結果作為驗證性研究來支持侖卡奈單抗的臨床獲益�����。
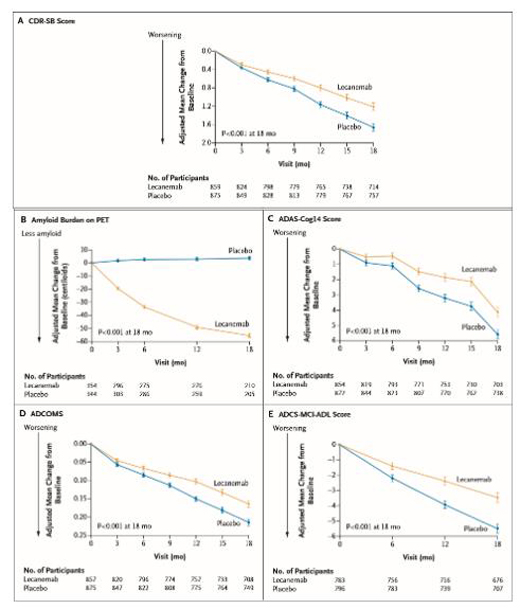
Clarity AD研究是一項多中心��、雙盲���、3期大型全球驗證性試驗�,共納入1795名早期阿爾茨海默病受試者����。根據(jù)11月底衛(wèi)材公布的新數(shù)據(jù),該研究達到了主要終點(CDR-SB)��,侖卡奈單抗顯示在減少臨床衰退方面具有高度顯著統(tǒng)計學意義����。具體而言:
在臨床癡呆評分總和量表CDR-SB方面����,侖卡奈單抗組和安慰劑組較基線的平均變化分別為1.21和1.66分,侖卡奈單抗組CDR-SB的臨床衰退幅度與安慰劑組相比減緩27%����。相比安慰劑組,治療組所有關鍵次要終點也顯示出統(tǒng)計學差異,包括專門衡量認知能力(包括記憶����、語言能力、文字識別等)的指標ADAS-Cog14���,AD綜合評分ADCOMS����,以及用于評估患者日常生活能力(比如穿衣�����、清潔��、購物)的指標ADCS MCI-ADL等���。包括:1)在淀粉樣PET亞組試驗中�,lecanemab自治療3個月開始就顯著減輕淀粉樣斑塊負擔(平均差:-59.1)��;2)基于ADAS-Cog14評分���,lecanemab治療18個月后延緩了26%的認知功能減退(平均差:-1.44 )����;3)基于ADCCOMS評估,lecanemab治療18個月后延緩了24%的疾病進展(平均差:-0.050)��;4)基于ADCS MCI-ADL評分����,lecanemab治療18個月后延緩了37%的日常生活能力減退(平均差:2.016)。
▲試驗主要終點和關鍵次要終點(截圖來源:參考資料[4])
在安全性方面��,lecanemab組26.4%的受試者出現(xiàn)輸液相關反應�����,12.6%受試者出現(xiàn)淀粉樣蛋白相關成像異常�����,伴有水腫或積液��。研究者認為����,需要更長的試驗來確定lecanemab治療早期阿爾茨海默病的療效和安全性��。
Clarity AD研究根據(jù)神經(jīng)變性的生物標志物評估結果顯示,侖卡奈單抗改善了星形膠質細胞活化的標志物——血清膠質纖維酸性蛋白(GFAP)和突觸功能障礙的標志物——腦脊液(CSF)神經(jīng)顆粒素�,且患者經(jīng)治療后均恢復至正常水平,而侖卡奈單抗和安慰劑之間的CSF或血清神經(jīng)纖維輕鏈無顯著差異���。
眾所周知�����,阿爾茨海默病對患者和他們的家人的健康和生活質量有著重要的影響����,隨著疾病程度的加劇���,患者逐漸失去參與社會活動����,以及自理的能力���,給家人和社會也帶來沉重的負擔���。根據(jù)阿爾茨海默病協(xié)會(Alzheimer’s Association)此前發(fā)布的新聞稿,詳細的3期Clarity AD研究數(shù)據(jù)表明����,侖卡奈單抗可以有意義地改變阿爾茨海默病早期患者的病程����。
聲明:本文版權歸原作者所有����,轉載文章僅為傳播更多信息,如作者信息標記有誤�����,或侵犯您的版權��,請聯(lián)系我們�,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com