6月6日��,中國國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)公示����,安進(Amgen)和百濟神州聯(lián)合申報的1類新藥AMG 509獲得臨床試驗?zāi)驹S可,擬開發(fā)用于治療轉(zhuǎn)移性去勢抵抗性前列腺癌����。公開資料顯示,這是一款可同時靶向STEAP1和CD3的雙特異性T細胞結(jié)合器���,目前正在海外開展治療去勢抵抗性前列腺癌的1期臨床試驗�。
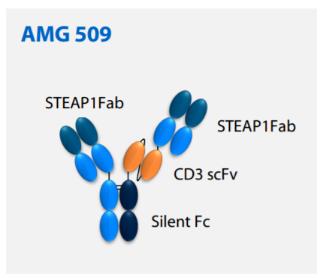
STEAP1(前列腺跨膜上皮抗原1)是一種由雄激素誘導(dǎo)并在前列腺癌中高表達的細胞表面抗原�����。STEAP1在尤因肉瘤(EWS)中也高度表達���,并且受到EWS-FLI1融合蛋白的調(diào)控����,EWS-FLI1融合是該惡性腫瘤的主要致癌驅(qū)動因素。CD3是效應(yīng)T細胞上的受體���,也是T細胞表面的重要標(biāo)志����。通過CD3介導(dǎo)T細胞特異性攻擊腫瘤細胞����,是T細胞導(dǎo)向的雙特異性抗體的主要作用機制。
公開資料顯示�����,AMG 509是一種新型人源化雙特異性T細胞募集抗體�,能與人、靈長類動物的STEAP1抗原和T細胞表面的CD3受體結(jié)合�。在結(jié)構(gòu)設(shè)計上,安進利用了Xencor公司的Xmab 2+1非對稱技術(shù)����,并且延長了這一蛋白的半衰期�����。此前,AMG 509已經(jīng)在研究中表現(xiàn)出顯著降低患者前列腺特異性抗原(PSA)水平的活性��,它還曾獲得美國FDA授予治療尤因肉瘤的孤兒藥資格�����。根據(jù)百濟神州官網(wǎng)資料介紹��,AMG 509是其與安進合作研發(fā)的管線之一�����,百濟神州擁有中國商業(yè)化權(quán)益���。
▲AMG 509分子模型(截圖來源:參考資料[2])
根據(jù)ClinicalTrials網(wǎng)站���,目前AMG 509正在開展一項治療轉(zhuǎn)移性去勢抵抗性前列腺癌患者的1期臨床試驗,目的是評估候選藥在成年受試者中的安全性和耐受性���,并確定較大耐受劑量(MTD)和2期推薦劑量(RP2D)��。
前列腺癌是全球男性常確診的惡性腫瘤之一��。大多數(shù)男性在確診時患有局部前列腺癌���,可通過手術(shù)或放療進行治療���。前列腺癌細胞的生長具有雄激素依賴性,故患者起初對雄激素剝奪治療(ADT)敏感����,而經(jīng)持續(xù)ADT后仍然發(fā)生疾病進展的患者會發(fā)展為轉(zhuǎn)移性去勢抵抗性前列腺癌(mCRPC)。據(jù)預(yù)估�����,有10%~20%的前列腺癌患者會于確診后5~7年內(nèi)發(fā)展成為mCRPC�。靶向STEAP1和CD3的雙特異性T細胞結(jié)合器有望為這類患者帶來一種新的治療選擇。
值得注意的是�����,不久前安進和百濟神州聯(lián)合申報的另一款產(chǎn)品tarlatamab的臨床試驗申請已在中國獲批�,這是一款靶向DLL3的雙特異性T細胞結(jié)合器,目前正在海外開展治療小細胞肺癌的3期臨床試驗�����。
聲明:本文版權(quán)歸原作者所有,轉(zhuǎn)載文章僅為傳播更多信息�����,如作者信息標(biāo)記有誤�,或侵犯您的版權(quán)�,請聯(lián)系我們,我們將在及時修改或刪除內(nèi)容��,聯(lián)系郵箱:marketing@360worldcare.com