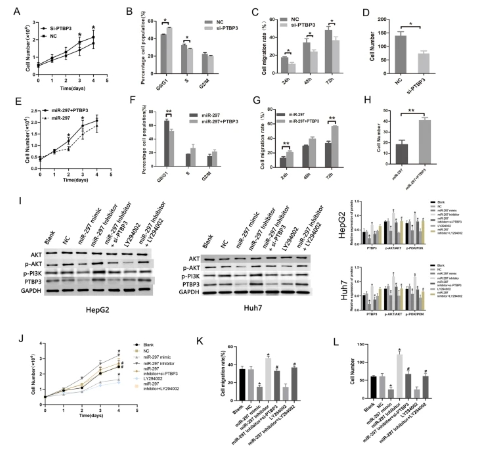
中南大學合作發(fā)現(xiàn)阻止肝癌生長���、遷移和侵襲的分子機制
近日,中南大學/中信湘雅生殖遺傳醫(yī)院/國家人類干細胞工程研究中心研究人員在國際期刊《Cell Death&Disease》上發(fā)表了題為”MiR-297 inhibits tumour progression of liver cancer by targeting PTBP3”的研究論文��, 該研究中��,研究人員報道了人羊膜上皮細胞(hAECs)條件培養(yǎng)基處理后�����,miR-297在hepG2細胞中的表達顯著增加�,可以抑制hepG2的增殖和遷移。而過表達miR-297在體外可抑制HCC細胞系的細胞增殖�、遷移和侵襲,在體內可抑制HCC的發(fā)生�����。聚嘧啶軌道結合蛋白3 (PTBP3)在HCC細胞系中被鑒定為miR-297的直接靶基因���,并介導miR-297在HCC細胞中的功能�����。此外���,體外細胞實驗證實,過表達miR-297可通過下調PTBP3表達抑制PI3K/AKT信號通路����,從而抑制HCC細胞的增殖、遷移和侵襲�����。綜上所述��,研究結果表明,miR-297可以下調PTBP3的表達�����,抑制PI3K/AKT信號通路的激活�����,從而阻止HCC的生長�、遷移和侵襲。
研究背景
肝癌是世界上第六大常見的惡性腫瘤和第四大常見的癌癥相關死亡原因��,僅在中國每年就占病例和死亡總數(shù)的50%左右���。肝細胞癌(HCC)占原發(fā)性肝癌病例的75%-85%�,其特點是預后差���,死亡率高�。盡管近手術技術的進步和5年生存率的提高��,但由于肝內復發(fā)和轉移率高����,HCC患者的長期預后仍然很差�。因此��,迫切需要闡明HCC發(fā)生和發(fā)展的分子機制�,以便更好地治療���。人羊膜上皮細胞(hAECs)是一種來源于胎膜的人胎盤成體干細胞���,是一種潛在的細胞治療和組織再生的新細胞來源。越來越多的證據(jù)證明了haec的抗腫瘤特性���。在本研究中��,研究人員證明了人羊膜上皮細胞(hAECs)條件培養(yǎng)基的處理可以抑制hepG2的增殖和遷移�����。然而�,haec抗腫瘤作用的分子機制尚不清楚��。
為了確定生長抑制的機制��,研究人員進行了miRNA陣列篩選miRNA的差異表達�。研究人員證明����,在人羊膜上皮細胞(hAECs)條件培養(yǎng)基處理后���,miR-297在HepG2細胞中的表達顯著增加���。MicroRNAs (miRNAs)是一組內源性進化保守的單鏈非編碼小RNA, miRNA作為基因表達的轉錄后調控因子,廣泛參與癌癥的發(fā)生����、發(fā)展和進展過程,如細胞增殖����、凋亡、轉移和耐藥等��,從而抑制或促進癌癥的發(fā)展�。近期,miR-297被發(fā)現(xiàn)參與腫瘤的發(fā)展�����。研究表明,與正常肝組織相比�����,miR-297在HCC組織中的表達明顯降低�。然而,miR-297在肝癌中的作用及其潛在機制尚不清楚��。由于miR-297在肝癌中的腫瘤抑制作用與其在結直腸癌��、肺腺癌和膠質母細胞瘤等其他類型癌癥中的腫瘤促進作用形成對比����,因此研究人員進一步研究了miR-297對肝癌腫瘤進展的影響�。
研究過程及發(fā)現(xiàn)
在本研究中,研究人員證明了miR-297在體外抑制HepG2和Huh7細胞的增殖和G1/S細胞周期轉變�����。它還能抑制肝癌細胞的侵襲和遷移�。根據(jù)miR-297在體外對肝癌的作用,研究人員對HepG2細胞進行了體內成瘤實驗����,發(fā)現(xiàn)miR-297在體內也抑制了HepG2細胞的致瘤性。這些結果表明miR-297在肝癌中具有潛在的腫瘤抑制作用���。
在臨床樣本中�����,miR-297水平在癌組織中比在非癌組織中有降低的趨勢��。這與以往研究發(fā)現(xiàn)HCC患者組織中miR-297的表達較正常肝組織明顯降低一致�。為了確認miR-297的表達是否與p53的表達相關,研究人員根據(jù)p53的表達水平將70例肝癌患者樣本分為p53陽性(1-12)組和p53陰性(0)組����。
多嘧啶束結合蛋白3 (PTBP3)在選擇性剪接(AS)調控、成熟���、轉運�、翻譯�、RNA衰變、儲存和轉換等轉錄后調控中起關鍵作用�����。PTBP3在乳腺浸潤性癌���、結腸腺癌���、肝細胞癌等腫瘤中均有高表達�。雖然PTBP3在人類各種腫瘤中的作用已被探索����,但PTBP3在肝細胞癌中的分子功能和機制尚缺乏。近期的研究表明����,PTBP3通過調節(jié)ZEB1 mRNA的穩(wěn)定性促進乳腺癌的上皮-間質轉化�����。研究人員證實PTBP3可促進MKN45人胃癌細胞增殖并抑制其分化�。本研究通過雙熒光素酶報告基因實驗確定了PTBP3是miR-297在肝癌中的直接靶基因,并通過細胞功能實驗研究了PTBP3敲低對HepG2細胞的影響�����。結果表明�����,PTBP3的降低抑制了HepG2細胞的生長、遷移和侵襲��,PTBP3的過表達恢復了miR-297過表達對HepG2細胞進展的抑制作用�����。
其他研究發(fā)現(xiàn)���,胃癌細胞中PTBP3的下調抑制了Akt的磷酸化����,Akt也被證明參與了HCC的生長和轉移��。多項研究報道了PI3K/AKT信號通路與HCC之間的密切聯(lián)系����,抑制該通路可能是一種可行的HCC治療方法。研究人員還發(fā)現(xiàn)miR-297過表達通過PTBP3抑制PI3K/AKT信號通路����,從而抑制HCC細胞的增殖、侵襲���、集落形成和遷移�。敲低PTBP3抑制HepG2細胞的生長和轉移,過表達PTBP3恢復了miR-297過表達對細胞進展的抑制作用�����。近期的研究將PTBP3定義為EMT的調節(jié)劑���,通過控制ZEB1的表達起作用����,這在乳腺腫瘤細胞中確立了PTBP3的致癌功能��。在本研究中��,PTBP3支持EMT轉錄程序的正常功能���,下調上皮標志物(E-cadherin),但上調間質標志物(Vimentin和N-cadherin)�����。MiR-297過表達誘導PTBP3表達降低�����,從而抑制肝癌細胞類似EMT過程。
PTBP3表達降低可阻斷PI3K/AKT信號通路���,抑制HCC細胞的增殖��、遷移和侵襲
研究意義
在本研究中�����,研究人員證明過表達miR-297在體外抑制肝癌細胞的增殖�、遷移和侵襲��,在體內抑制肝癌細胞的腫瘤發(fā)生�����。研究人員在肝癌細胞中發(fā)現(xiàn)PTBP3是miR-297的直接靶基因����。Mir-297可直接靶向PTBP3,失活PI3K/AKT信號通路�����,抑制HCC細胞系的生長�����、遷移和侵襲。因此���,miR-297可能是一個有效的潛在肝癌治療靶點�。
聲明:本文版權歸原作者所有��,轉載文章僅為傳播更多信息�,如作者信息標記有誤,或侵犯您的版權�����,請聯(lián)系我們�����,我們將在及時修改或刪除內容���,聯(lián)系郵箱:marketing@360worldcare.com