復旦大學中山醫(yī)院:發(fā)現(xiàn)癌轉移治療新策略
6月26日�,復旦大學中山醫(yī)院研究團隊在期刊《Cell Death Discovery》上發(fā)表了研究論文��,題為“Mobilization and activation of tumor-infiltrating dendritic cells inhibits lymph node metastasis in intrahepatic cholangiocarcinoma”����。本研究發(fā)現(xiàn)���,腫瘤細胞內源性β-連環(huán)蛋白激活是ICC中LNM時破壞DC介導的抗腫瘤免疫的關鍵機制�。FL-pIC療法或β-連環(huán)蛋白抑制劑可能值得作為一種潛在的方案來緩解ICC細胞向LN的轉移并實現(xiàn)有效的腫瘤免疫控制。
研究背景
肝內膽管癌(ICC)約占原發(fā)性肝癌的10-20%�,在過去20年中全球范圍內的發(fā)病率和死亡率均呈上升趨勢。手術切除是ICC唯一的潛在治愈方法�,但術后5年生存率仍然很低,主要是由于腫瘤復發(fā)率較高����。其中,淋巴結轉移(LNM)是ICC患者進行根治性切除后常見的風險因素之一�����,已被證實與快速腫瘤復發(fā)和不良長期生存有關����。根據(jù)美國聯(lián)合委員會癌癥分期系統(tǒng)(AJCC)第8版TNM分期方案,ICC中LNM的存在表明腫瘤處于更晚期���。然而��,腫瘤向淋巴結轉移的分子機制尚不為人所知��。對腫瘤微環(huán)境的全面分析有助于加深我們對LNM機制的理解����,并為ICC設計更有效的抗癌療法。
研究進展
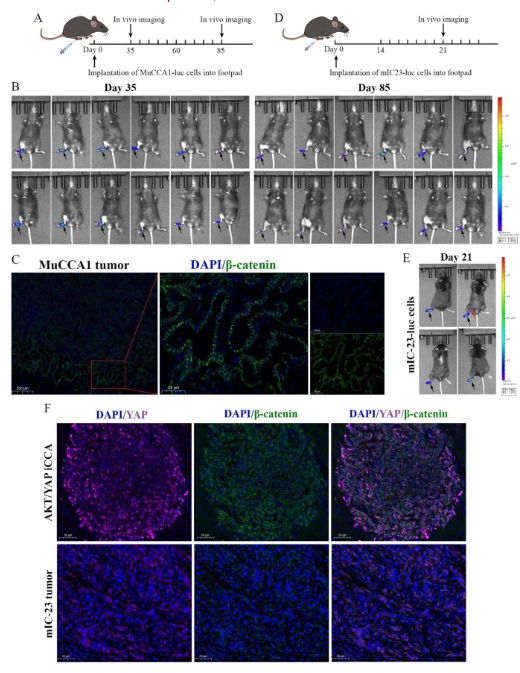
研究人員將TLR3激動劑聚肌胞(poly(I:C))與Flt3L聯(lián)合使用�,促進Flt3L動員的DCs的成熟和激活。研究人員首先探索是否可以使用MuCCA1細胞構建足墊腫瘤LNM模型����。然而,在第35天和第85天的體內動態(tài)成像顯示���,MuCCA1細胞的LNM潛力有限�����,因此不適合構建LNM模型�,這可能是由于缺乏β連環(huán)蛋白信號激活的證據(jù)�����,即膜β連環(huán)蛋白IF染色����。然后,研究人員轉向了另一種從AKT/YAP誘導的ICC中建立的細胞系mIC-23����,發(fā)現(xiàn)mIC-23細胞可以構建腫瘤LNM模型。此外�,在AKT/YAP驅動的ICC病變和mIC-23足墊腫瘤中進行的YAP和β連環(huán)蛋白的IF染色顯示,YAP和β連環(huán)蛋白同時在核內共定位�����,提示兩者信號的完全激活���。
研究人員接下來在體內使用mIC-23足墊腫瘤LNM模型研究聯(lián)合FL-pIC療法的治療效果����。將熒光素酶(Luc)-標記的mIC-23細胞植入足墊區(qū)域后��,研究人員將小鼠隨機分為2組(每組9只)���,并接受相應的治療�����。體內生物熒光成像顯示����,與PBS組相比,F(xiàn)L-pIC療法顯著抑制了mIC-23腫瘤細胞向腘窩LN的轉移���。研究人員取出主要足墊腫瘤���、腘窩LN和腹股溝LN。同樣�����,F(xiàn)L-pIC治療抑制了mIC-23足墊腫瘤的生長�����。研究人員還觀察到與對側正常LN相比��,腫瘤引流的腘窩LN體積更大����。腘窩LN的H&E染色和CK19免疫組化染色進一步證實,F(xiàn)L-pIC療法顯著抑制了LN轉移����,而不影響腫瘤引流的腘窩LN的大小。此外�,腘窩LN的IF染色顯示���,轉移的mIC-23細胞的核內有YAP和β-連環(huán)蛋白的陽性染色。
利用小鼠ICC細胞系構建足墊腫瘤LNM模型的探索
研究結論
綜上���,研究結果表明,β-連環(huán)蛋白激活導致DC被排斥進入ICC腫瘤微環(huán)境��,并通過阻斷CXCL12的產生來實現(xiàn)����。在腫瘤內擴張和激活cDCs代表了一種有前途的治療策略,有助于減輕腫瘤細胞向LNs的轉移����。
聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息�,如作者信息標記有誤,或侵犯您的版權���,請聯(lián)系我們����,我們將在及時修改或刪除內容���,聯(lián)系郵箱:marketing@360worldcare.com