浙江中醫(yī)藥大學聯(lián)合浙江大學:發(fā)現結腸癌治療靶向新藥
7月3日,浙江中醫(yī)藥大學聯(lián)合浙江大學研究人員在期刊《 Cell Death & Disease》上發(fā)表了研究論文����,題為“Selective PI3Kδ inhibitor TYM-3-98 suppresses AKT/mTOR/SREBP1-mediated lipogenesis and promotes ferroptosis in KRAS-mutant colorectal cancer”。本研究表明����,鐵死亡的誘導是通過抑制AKT/mTOR/ srebp1介導的脂肪生成來促進PI3Kδ抑制劑誘導的細胞死亡的,因此顯示出TYM-3-98在CRC治療中有前景的治療效果���。
背景知識
結直腸癌(CRC)是全球第三大常見惡性腫瘤和第三大致命癌癥����。目前,化療是CRC常見的治療方法之一�����,包括5-氟尿嘧啶����、伊立替康、奧沙利鉑�����、亞葉酸鈣和卡培他濱等藥物��。此外�����,抗VEGF和EGFR單克隆抗體聯(lián)合化療也改善了CRC的預后���。然而���,這些治療策略仍然面臨著從癌癥復發(fā)�����、耐藥到明顯毒性的挑戰(zhàn)。因此�,迫切需要更有效的治療方法,尤其是對于缺乏有效靶向治療的KRAS或NRAS序列變異患者�����。
PI3K-AKT-mTOR信號通路在生理和病理條件下對細胞的生長和生存起著重要作用����,其過度激活在CRC的發(fā)生和發(fā)展過程中具有重要意義。此外�,PTEN是PI3K通路的負性調節(jié)因子,在CRC原發(fā)腫瘤中通常缺失���,并且與死亡風險增加和總生存期較差相關�。因此�,PI3K通路是治療CRC的一個有前景的治療靶點。
近期的研究報道���,與無KRAS G12R突變的患者相比��,有KRAS G12R突變的胰腺導管腺癌(PDA)患者有較長的總生存期�����,但這一優(yōu)勢被伴隨的PI3K改變所抵消���。通過KRAS/PI3K基因圖譜可以預測PDA患者的治療脆弱性��,提示靶向KRAS突變中的PI3K可能是治療CRC的新策略���。
TYM -3 - 98誘導CRC細胞發(fā)生鐵死亡
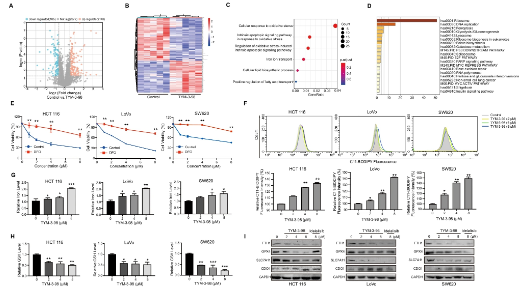
為了進一步了解TYM-3-98抗腫瘤作用的分子機制,研究人員首先測定了TYM-3-98處理后的凋亡細胞比例����。與之前抑制PI3K導致白血病細胞凋亡的報道不同,TYM-3-98并沒有顯著增加HCT 116�、LoVo和SW620細胞的凋亡水平。為了闡明TYM-3-98誘導細胞死亡的機制�����,研究人員將TYM-3-98處理的HCT 116細胞進行蛋白質組學分析�。對照組與TYM -3 - 98處理組比較,共檢測到248個差異表達蛋白(P值< 0.01,倍數變化>1.5)���。研究結果顯示��,治療組有105個蛋白表達下調���,143個蛋白表達上調?�;谶@些差異表達的蛋白��,研究人員進行了生物信息學分析�,以確定TYM-3-98改變的關鍵通路����。研究分析發(fā)現,給予TYM-3-98后�,鐵死亡通路、細胞氧化應激和鐵離子轉運被強烈激活�。這些結果提示鐵死亡過程可能參與了TYM-3-98對CRC的增殖抑制。
鐵死亡被認為是一種程序性氧化性細胞死亡����,伴隨脂質過氧化和鐵蓄積,導致活性氧簇的產生��。為了驗證蛋白質組學結果,研究人員首先使用鐵螯合劑DFO來確定鐵死亡是否在TYM -3 - 98誘導的細胞死亡中發(fā)揮作用����。如圖2E所示,DFO抑制鐵死亡顯著恢復了TYM-3-98處理后的CRC細胞活力抑制����。進一步的評估表明,在24小時內��,TYM-3-98誘導了快速的濃度依賴性脂質過氧化物積累�,伴隨著細胞內鐵的增加和抗氧化劑GSH的減少。GPX4是鐵死亡細胞中重要的抗氧化酶之一�,也是鐵死亡細胞的重要調節(jié)因子。研究表明����,GPX4和SLC7A11的激活可抑制鐵死亡。與這些報道一致�,TYM-3-98降低了GPX4、SLC7A11和鐵蛋白重鏈(FTH1)的表達水平����,同時升高了半胱氨酸雙加氧酶1 (CDO1)。綜上所述,這些數據表明TYM -3 - 98誘導的鐵死亡在體外抑制CRC細胞增殖�。
綜上所述,這些結果表明��,TYM-3-98可以通過抑制PI3Kδ誘導HCT 116, LoVo和SW620細胞的鐵死亡����,從而發(fā)揮抗CRC的特性。
研究結論
綜上所述���,TYM-3-98是一種新型的選擇性PI3Kδ抑制劑和鐵死亡誘導劑����,在體外和體內都具有抗結直腸癌的活性�����,使其成為潛在的結直腸癌靶向藥物���。
聲明:本文版權歸原作者所有,轉載文章僅為傳播更多信息���,如作者信息標記有誤����,或侵犯您的版權,請聯(lián)系我們����,我們將在及時修改或刪除內容,聯(lián)系郵箱:marketing@360worldcare.com