北京大學發(fā)文:可治療肝癌的納米顆粒
8月28日����,北京大學研究團隊在期刊《Cell Death Discovery》上發(fā)表了題為“Metal-polyphenol-network coated R612F nanoparticles reduce drug resistance in hepatocellular carcinoma by inhibiting stress granules”的研究論文����,本研究中�,研究人員證明了p110α是SGs組裝所必需的。從機制上講���,p110α的Arg-Gly (RG)基序是SG能力所必需的,并調節(jié)SG成分的募集�。蛋白精氨酸甲基轉移酶1 (PRMT1)介導的p110α甲基化干擾了p110α向SG組分的募集,從而抑制了p110α向SGs的促進�。在此基礎上,研究人員制備了金屬多酚網絡包被的R612F納米顆粒(MPN-R612F)�����,該納米顆??梢愿咝нM入HCC細胞,維持p110α的超甲基化狀態(tài)���,從而抑制SGs的組裝�����,終降低HCC細胞對索拉非尼的耐藥性����。MPN-R612F納米顆粒與索拉非尼聯(lián)合使用可以更有效地殺傷HCC細胞��,發(fā)揮更強的抗腫瘤作用���。本研究為靶向SGs治療HCC提供了新的視角�。
背景知識
肝細胞癌(HCC)是常見的惡性腫瘤,長期威脅著人類的健康�����。HCC早期預后良好����,但由于其隱蔽性較強,多數發(fā)現時已進入中晚期�。目前的治療效果不足,因此死亡率較高�。對于不符合手術治療條件的患者,化療是較佳選擇���。索拉非尼是一種多激酶抑制劑���,可促進細胞凋亡,減少血管生成��,抑制腫瘤細胞增殖���,目前是晚期HCC的有效一線治療藥物�。不幸的是,對索拉非尼的耐藥性越來越普遍���。據報道�����,索拉非尼在各種來源的癌細胞中是應激顆粒(SGs)的有效誘導劑,包括HCC����、前列腺癌、乳腺癌�、宮頸癌細胞。相應地���,SGs的形成有助于HCC細胞對索拉非尼的耐藥���。
SGs被認為是一種無膜細胞器,是細胞抵御外界應激的一種保護機制���。它們主要由停滯的翻譯起始前復合物(PICs)組成�����,包括核糖體大小的亞基�����、翻譯起始因子和許多RNA結合蛋白���。SGs的形成有多種原因��,如氧化應激���、內質網應激、熱休克�、缺氧、饑餓���、病毒感染或藥物誘導等��。SGs已被證實存在于多種腫瘤中�����,其某些核心蛋白的高表達往往與HCC呈正相關�����。同時����,當肝癌細胞暴露于化療等環(huán)境應激時,通常會調用SGs來修復應激誘導的變化���,終抑制肝癌細胞凋亡���。SGs的持續(xù)積累常導致化療耐藥性的增加���。探索SGs形成機制對改進HCC治療策略具有重要意義�����。
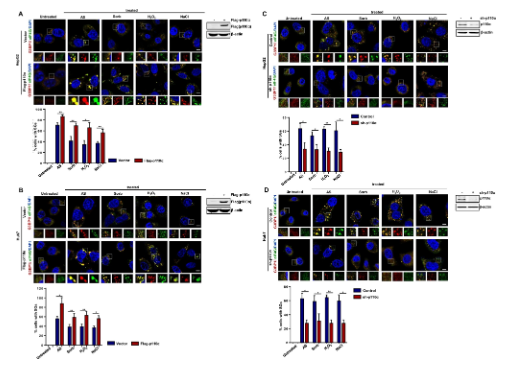
p110α調節(jié)肝癌細胞中SGs的形成
研究人員使用p110α過表達系統(tǒng)和慢病毒介導的敲低來研究p110α對HepG2和Huh7細胞系中SGs形成的影響�。以G3BP1和另一種典型的SG組分eIF4G為標記物���,免疫熒光實驗表明�����,p110α過表達顯著且均勻地促進AS-�����、Sorb-���、H2O2-和NaCl-誘導的SGs形成�。免疫熒光融合圖像(黃色)表示SGs灶陽性細胞��。通過shRNA敲低HepG2和Huh7細胞中p110α的表達���,觀察其對4種不同化學物質誘導的SGs組裝的影響�。如圖1C, D所示���,在壓力下�����,p110α敲低后SGs檢測明顯低于對照組�����。此外���,研究人員還檢測了去除AS后SGs的形成���,p110α過表達延遲了As去除后SGs的拆卸。而在p110α敲低的各組中��,SGs幾乎未檢測到�。這些結果表明,p110α不僅促進應力誘導的SG組裝���,而且延緩應力去除后SG的拆卸�����。綜上所述,這些結果表明p110α是SG動力學的核心調節(jié)器�,負責SGs的組裝和拆卸。
圖1:p110α調控肝癌細胞中SGs的形成
PRMT1誘導的p110α甲基化可抑制肝癌細胞SGs的組裝
研究人員將PRMT1與野生型p110α或突變型R612A共轉染HepG2和Huh7細胞����,免疫熒光實驗顯示,過表達PRMT1顯著抑制p110α促進SG形成的作用��,但對R612A促進SG形成的作用無影響���。而PRMT1敲除顯著增強了p110α促進SG裝配的作用�����,但對R612A促進SG裝配的作用無影響�����。prmt1誘導的p110α甲基化可抑制p110α介導的SG組裝��。蛋白質免疫印跡實驗檢測證實上述細胞株構建成功���。機制上�,PRMT1敲除顯著增強了p110α與SG成核蛋白RPS6和RPL4的相互作用��,而PRMT1過表達顯著抑制了p110α與SG成核蛋白的結合���。因此����,PRMT1敲除消除了p110α ADMA信號����,而PRMT1過表達誘導了p110α ADMA信號�,表明PRMT1介導的精氨酸甲基化抑制了p110α與sgs相關元件的結合����。綜上所述,這些結果證實了PRMT1是一個重要的分子開關��,通過介導p110α精氨酸甲基化在SG動力學的調節(jié)中發(fā)揮作用�����。
設計納米顆粒MPN-R612F以增強索拉非尼的抗腫瘤能力
在本研究中�,研究人員還發(fā)現索拉非尼處理顯著誘導了應激顆粒的聚集,而對照組沒有����。有趣的是,研究人員索拉非尼處理后��,HepG2和Huh7細胞中PRMT1蛋白水平降低���,而p110α蛋白水平保持不變。同時��,索拉非尼治療顯著降低了p110α甲基化水平����。索拉非尼與SGs�、甲基化p110α之間存在一定的相關性���。研究人員構建了一個陽性(Arg/Phe)突變R612F���,該突變通過將精氨酸替換為苯丙氨酸來模擬組成性精氨酸甲基化,苯丙氨酸具有類似大小的烴鏈�����,并且攜帶大量疏水部分��。Phe突變引起的疏水作用對可甲基化的精氨酸殘基具有特異性����,能夠模擬精氨酸的甲基化,導致p110α呈現高甲基化狀態(tài)�。蛋白質印跡法分析證實,在PRMT1缺失的情況下���,R612F確實發(fā)生了甲基化���,其甲基化效應與PRMT1對p110α的甲基化效應相似����。因此�,研究人員計劃基于突變體R612F設計一種納米顆粒。
研究表明���,研究人員設計的MPN-R6-12F納米顆?�?梢酝ㄟ^抑制應激顆粒的形成有效殺死腫瘤��,對肝臟和腎臟的損傷較小�����。與索拉非尼聯(lián)合使用可顯著增強索拉非尼的抗腫瘤效果�����。
研究小結
綜上�,本研究揭示了p110α通過調節(jié)SGs蛋白之間的相互作用來促進SGs的形成���。prmt1介導的p110α甲基化在肝癌細胞對索拉非尼的耐藥中起重要作用���。MPN-R612F聯(lián)合索拉非尼可能克服傳統(tǒng)抗癌藥物產生的藥物耐受性,為傳統(tǒng)治療策略失敗的HCC治療提供新的臨床視角��。
聲明:本文版權歸原作者所有�����,轉載文章僅為傳播更多信息���,如作者信息標記有誤�,或侵犯您的版權�,請聯(lián)系我們,我們將在及時修改或刪除內容���,聯(lián)系郵箱:marketing@360worldcare.com