10月31日���,中國國家藥監(jiān)局藥品審評中心(CDE)官網(wǎng)新公示����,強生(Johnson & Johnson)公司申報的埃萬妥單抗(amivantamab)皮下注射劑型就兩項新適應(yīng)癥獲批臨床,擬定適應(yīng)癥包括:聯(lián)合FOLFIRI用于經(jīng)系統(tǒng)治療的RAS/RAF野生型����、復(fù)發(fā)轉(zhuǎn)移性結(jié)直腸癌;聯(lián)合mFOLFOX6或FOLFIRI用于RAS/RAF野生型�,左側(cè)、不可切除或轉(zhuǎn)移性結(jié)直腸癌��。
截圖來源:CDE官網(wǎng)
埃萬妥單抗是一款靶向EGFR和MET的在研全人源化雙特異性抗體�����,它除了能夠阻斷EGFR和MET介導(dǎo)的信號傳導(dǎo)以外�����,還可以引導(dǎo)免疫細(xì)胞靶向攜帶激活性和抗性EGFR/MET突變和擴增的腫瘤�����。公開資料顯示�����,埃萬妥單抗的靜脈制劑早于2021年5月獲得FDA的加速批準(zhǔn),此后陸續(xù)獲批多項適應(yīng)癥���,涵蓋不同類型的非小細(xì)胞肺癌患者��。埃萬妥單抗皮下注射劑型上市申請也于今年6月和9月陸續(xù)獲得FDA和NMPA受理�����,可用于目前已批準(zhǔn)或已提交的所有埃萬妥單抗靜脈制劑的適應(yīng)癥����。
鑒于MET擴增與轉(zhuǎn)移性結(jié)直腸癌(mCRC)對抗EGFR治療的耐藥有關(guān)�。因此研究人員認(rèn)為,埃萬妥單抗作為EGFR和MET的雙重共抑制劑�����,可以改善復(fù)發(fā)/難治性mCRC的預(yù)后�����。由此�,強生此前已經(jīng)開展了一項名為OrigAMI-1的1/2期臨床研究,評估埃萬妥單抗作為難治性mCRC患者單藥治療的安全性和有效性���。
通過ctDNA檢測���,符合條件的患者為KRAS、NRAS���、BRAF和EGFR外域野生型��,無ERBB2/HER2擴增����。其中���,隊列A和B分別為此前沒有/此前暴露于抗EGFR單克隆抗體的左側(cè)mCRC患者����,隊列C為右側(cè)mCRC患者(無論是否接受過抗EGFR治療)�����。
根據(jù)研究人員在2024年美國臨床腫瘤學(xué)會胃腸癌研討會年會(2024 ASCO GI)上公布的數(shù)據(jù)��,A、B和C組的疾病控制率(DCR)分別為88.2%�����、72.2%和77.8%�。A組和B組確定的應(yīng)答者的中位反應(yīng)持續(xù)時間(mDoR)分別為7.5個月和7.4個月,隊列C中應(yīng)答者的治療仍在繼續(xù)����。初步的生物標(biāo)志物數(shù)據(jù)表明,埃萬妥單抗可能在與抗EGFR抗體耐藥性相關(guān)的改變中具有活性(例如EML4-ALK融合��,PTEN)�����。研究沒有觀察到新的安全信號��。
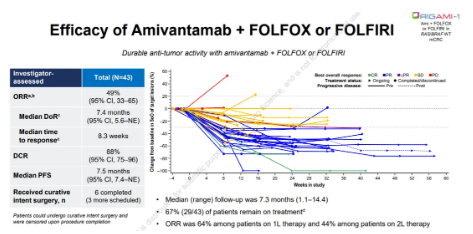
在ESMO大會上�,強生則公布了OrigAMI-1的更新數(shù)據(jù),埃萬妥單抗+FOLFOX或FOLFIRI 1L或2L治療RAS/BRAF野生型mCRC患者依舊展現(xiàn)出有希望的抗腫瘤活性�����,總體ORR為49%��,DCR為88%。研究人員還觀察到有臨床意義的肝內(nèi)抗腫瘤活性���,肝內(nèi)ORR為53%,肝內(nèi)DCR為93%�。值得一提的是,由于該產(chǎn)品較好的抗腫瘤活性�,還有有21%的患者得以進行根治性手術(shù)。
▲OrigAMI-1研究結(jié)果(截圖來源:強生官網(wǎng))
根據(jù)強生此前新聞稿介紹����,評估基于埃萬妥單抗的方案作為結(jié)直腸癌一線和二線治療的關(guān)鍵3期注冊試驗(OrigAMI-2、OrigAMI-3)正在計劃中���。而該3期臨床試驗也計劃使用給藥更方便的埃萬妥單抗的皮下注射劑型��?���;颊吣軌蛟?分鐘完成該皮下制劑的注射����,顯著縮短給藥時間。
本次這款埃萬妥單抗皮下注射劑型獲批新的臨床研究默示許可�,意味著該項該產(chǎn)品即將在中國開展針對結(jié)直腸癌的臨床研究�。
聲明:本文版權(quán)歸原作者所有����,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤����,或侵犯您的版權(quán),請聯(lián)系我們��,我們將在及時修改或刪除內(nèi)容��,聯(lián)系郵箱:marketing@360worldcare.com