暨南大學曲辰團隊:肝癌的靶向治療新策略
11月21日����,暨南大學曲辰研究團隊在期刊《Molecular Cancer》上發(fā)表了題為“Myofibroblast-derived extracellular vesicles facilitate cancer stemness of hepatocellular carcinoma via transferring ITGA5 to tumor cells”的研究論文���,本研究中���,分析結果顯示,ITGA5在HCC組織的間質成纖維細胞中高度富集���,并促進腫瘤進展和不良預后���。尤其是���,ITGA5通過間質成纖維細胞的外泌體向HCC細胞傳遞,誘導其獲得癌干細胞樣特性���。機制上��,ITGA5直接與YES1結合�,促進YES1及其下游通路的激活�,從而增強HCC細胞的干細胞特性。此外���,在HCC小鼠模型中�,阻斷ITGA5會抑制由ITGA5+間質成纖維細胞驅動的腫瘤進展���,并增強PD-L1治療的療效。本研究闡明了由EV介導的從肌成纖維細胞向腫瘤細胞轉移ITGA5的新機制���,從而增強了HCC的干細胞特性��。靶向ITGA5的治療有助于阻止HCC的進展���,并改善PD-L1治療的效果�。
背景信息
肝細胞癌(HCC)是一種全球預后不良的侵襲性惡性腫瘤����。手術切除是HCC的主要治療手段;然而��,手術切除的適應癥限制了其在特定人群中的應用�����。此外����,大約有50-70%的HCC患者在接受局部治療后5年內會出現疾病復發(fā)。盡管免疫療法已顯示出益處�,但其對晚期或復發(fā)性HCC患者的治療效果仍不令人滿意。
腫瘤微環(huán)境(TME)在惡性腫瘤的發(fā)生和發(fā)展中起著關鍵作用��。作為肝癌(HCC)微環(huán)境的重要組成部分�,成纖維細胞樣細胞在HCC進展和復發(fā)中發(fā)揮著重要作用。肝纖維化組織中,成纖維細胞樣細胞通過α-平滑肌肌動蛋白(α-SMA)和膠原蛋白I的表達而被識別?����,F有的證據表明��,成纖維細胞樣細胞可能主要起源于激活的肝星狀細胞(HSCs)�����。在正常肝臟組織中沒有成纖維細胞樣細胞的存在�。然而,在慢性損傷的肝臟纖維化組織中��,它們參與了細胞外基質的產生和肝纖維化的發(fā)展�����。大多數HCC患者存在不同程度的肝纖維化���,這增強了HCC微環(huán)境中成纖維細胞樣細胞的浸潤��。成纖維細胞樣細胞在TME中的浸潤通過多種機制促進HCC進展���。成纖維細胞樣細胞通過分泌細胞因子或細胞外囊泡(EVs)增強HCC細胞的增殖、遷移�����、侵襲和癌干細胞樣(CSC-like)特性��。
阻斷ITGA5可改善HCC在體內的進展
為了研究靶向ITGA5在HCC中的治療潛力��,研究人員設計了一種新型的ITGA5靶向肽模擬物AV3�����,并在體外和體內進行給藥����。研究人員用5-羧基熒光素(5FAM)標記的AV3進行體外結合研究,結果顯示AV3與ITGA5-EV處理的HCC細胞的結合能力強于未處理的HCC細胞�����。此外����,AV3有效抑制了ITGA5-EV誘導的HCC細胞的增殖和球形形成,并降低了EV處理的HCC細胞中CSC標志物MYC�����、EPCAM和SOX2的表達。
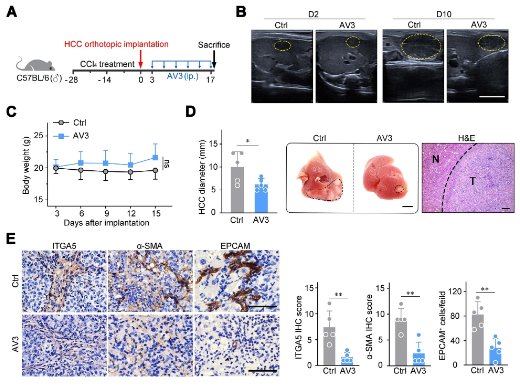
之前的研究發(fā)現�����,在移植到正常肝臟小鼠體內的HCC組織中��,存在少量的成纖維細胞樣細胞��。尤其是�����,預先用四氯化碳(CCl4)灌胃顯著增強了移植到正常肝臟小鼠體內的HCC組織中的成纖維細胞樣細胞的浸潤���。為了模擬成纖維細胞樣細胞的浸潤并研究ITGA5+成纖維細胞在HCC進展中的功能�,研究人員在用CCl4灌胃預處理的小鼠中建立了HCC模型��。在這種原位HCC小鼠模型中���,研究人員發(fā)現AV3治療顯著抑制了HCC的生長��,而不影響體重����。此外,免疫組織化學染色顯示���,ITGA5治療顯著降低了原位HCC組織中干細胞標記物EPCAM的表達。這些證據證實��,ITGA5阻斷降低了HCC細胞的干細胞特性���。而且���,研究結果還表明,從接受AV3治療的小鼠體內提取的HCC組織中����,ITGA5+和α-SMA+細胞的數量減少了。這些數據表明��,ITGA5阻斷還降低了HCC組織中的ITGA5+成纖維細胞浸潤�����。
阻斷ITGA5可以改善HCC在體內的進展
抑制ITGA5可以增強PD-L1阻斷治療的效果
雖然PD-1或PD-L1阻斷治療已成為晚期HCC的重要治療選擇�����,但只有20-30%的患者對此療法有響應。越來越多的證據表明�,成纖維細胞或癌相關成纖維細胞調節(jié)腫瘤免疫微環(huán)境,影響PD-1或PD-L1阻斷治療的效果�����。生物信息學分析顯示���,ITGA5表達與癌相關成纖維細胞浸潤��、間質評分��、免疫細胞浸潤和免疫檢查點相關基因表達相關����。這表明ITGA5影響ICI的療效�。因此,研究人員利用CCl4預處理的原位HCC小鼠模型來研究是否抑制ITGA5可以增強ICI的治療效果��。
為了評估ITGA5阻斷在改善ICI治療效果方面的作用���,研究人員將小鼠分為免疫球蛋白G(IgG)組����、生理鹽水組、ITGA5抑制劑AV3組��、PD-L1抗體組或PD-L1抗體與AV3的聯合治療組��。生物熒光成像顯示�����,在肝癌移植后2天��,即可檢測到腫瘤���。可是�,這些組之間的熒光強度沒有顯著差異。然而��,在肝癌移植后10天���,聯合治療組的原位肝癌的熒光強度顯著低于接受抗PD-L1或AV3治療的小鼠記錄的熒光強度�。與單獨使用AV3或抗PD-L1治療相比�����,AV3和PD-L1抗體的聯合治療也顯著延長了原位肝癌小鼠的生存時間。此外��,分析結果還表明����,AV3和抗PD-L1的聯合治療顯著降低了肝內轉移的發(fā)生率。
研究結果進一步證實聯合治療的抗HCC作用��。結果還表明���,AV3和抗pd - l1聯合治療比單獨使用AV3或抗pd - l1治療能更好地控制HCC的進展��。為了評估AV3對HCC TME的影響�,研究人員通過多重免疫熒光和免疫組化評估了TME細胞的浸潤情況����。單藥和聯合治療均影響髓源性抑制細胞和腫瘤相關巨噬細胞浸潤。
然而����,聯合療法顯著增加了CD8+和CD4+T細胞的浸潤。值得注意的是����,只有AV3單藥療法和聯合療法顯著降低了ITGA5+肌成纖維細胞(ITGA5+α-SMA+細胞)的浸潤�。此外�����,研究人員比較了各組小鼠腫瘤組織中M1巨噬細胞和M2巨噬細胞的浸潤情況��。結果顯示�����,靶向ITGA5增強了PD-L1對M2巨噬細胞的抑制作用����;但對M1巨噬細胞沒有顯著影響����。
結論
本研究發(fā)現了一種新的調控途徑,其中肌成纖維細胞通過產生將ITGA5轉移到HCC細胞的EVs來增強HCC細胞的干性��。在機制上���,研究人員發(fā)現ITGA5主要通過激活YES1及其下游通路來增強HCC細胞的干細胞性�����。此外�����,本研究揭示了ITGA5是HCC的潛在治療靶點����,靶向ITGA5是提高免疫治療療效的新策略。
聲明:本文版權歸原作者所有����,轉載文章僅為傳播更多信息,如作者信息標記有誤���,或侵犯您的版權�,請聯系我們����,我們將在及時修改或刪除內容,聯系郵箱:marketing@360worldcare.com