免疫檢查點抑制劑(Immune checkpoint blockade, ICB)能夠破壞腫瘤細(xì)胞對免疫監(jiān)視的逃逸����,極大地改變腫瘤病人的治療模式 【1】。盡管基于免疫檢查點開發(fā)的抑制劑藥物���,如PD-1抗體���,在多種腫瘤治療中取得良好療效,然而在臨床實驗中仍有部分患者無法獲益�����,如基因組微衛(wèi)星穩(wěn)定(Microsatellite stable, MSS)的結(jié)直腸癌病人【1-3】��。
之前���,張澤民團隊與合作者開發(fā)了STARTRAC生物信息學(xué)方法���,首次對結(jié)直腸癌單個浸潤T淋巴細(xì)胞的特征及其動態(tài)變化進行了系統(tǒng)性地刻畫,發(fā)現(xiàn)并解析了基因組微衛(wèi)星穩(wěn)定和不穩(wěn)定病人的T細(xì)胞差異【4】�。相關(guān)工作已于2018年10月29日,以“Lineage tracking reveals dynamic relationships of T cells in colorectal cancer”為題發(fā)表在Nature雜志上���。
在腫瘤微環(huán)境中����,除淋巴細(xì)胞外,髓系免疫細(xì)胞(Myeloid cell)作為主要的抗原提呈細(xì)胞在腫瘤免疫中同樣發(fā)揮重要的功能����。多項靶向髓系免疫細(xì)胞如腫瘤相關(guān)巨噬細(xì)胞(Tumor-associated macrophage, TAM)和樹突狀細(xì)胞(Dendritic cell, DC )的治療策略已進入臨床前試驗。然而這些細(xì)胞在結(jié)直腸癌腫瘤微環(huán)境中的特征�,其與T細(xì)胞等其他細(xì)胞的相互作用關(guān)系,以及其靶向藥物的作用機理尚未得到全面闡釋���。
2020年4月16日�,北京大學(xué)生物醫(yī)學(xué)前沿創(chuàng)新中心(BIOPIC)��、生命科學(xué)學(xué)院����、北京未來基因診斷高精尖創(chuàng)新中心(ICG)、北大-清華生命科學(xué)聯(lián)合中心(CLS)張澤民課題組聯(lián)合美國安進(Amgen)公司Jackon G. Egen���、Yu Xin團隊和北京大學(xué)人民醫(yī)院申占龍課題組在Cell上以Article形式發(fā)表了題為Single-Cell Analyses Inform Mechanisms of Myeloid-Targeted Therapies in Colon Cancer的研究論文�����。該研究在單細(xì)胞水平對結(jié)直腸癌患者的腫瘤微環(huán)境��,特別是浸潤髓系細(xì)胞類群首次進行了系統(tǒng)性的刻畫���,分析了TAM和DC細(xì)胞的類群特征、譜系發(fā)育及其與T細(xì)胞和其他細(xì)胞間相互作用關(guān)系��?���;谝陨辖Y(jié)果,研究團隊分別對接受anti-CSF1R抑制劑和anti-CD40激動劑的小鼠模型進行單細(xì)胞測序����,揭示了這兩種靶向髓系細(xì)胞的免疫治療策略潛在的作用機理。此項國際前列的開創(chuàng)性工作�����,建立了結(jié)合腫瘤患者及小鼠模型的單細(xì)胞轉(zhuǎn)錄組來研究腫瘤免疫治療的范例��,可為人們研究其他疾病中免疫細(xì)胞以及開發(fā)新的治療方案提供思路����。
1. 結(jié)直腸癌腫瘤中浸潤著兩群狀態(tài)迥異的巨噬細(xì)胞
研究人員首先使用10x及Smart-seq2兩種技術(shù)對從結(jié)直腸癌患者中收集的免疫和非免疫細(xì)胞進行單細(xì)胞轉(zhuǎn)錄組測序�,從中鑒定出包括T細(xì)胞�����、B細(xì)胞���、先天性淋巴細(xì)胞(Innate lymphoid cell, ILC)�����、髓系細(xì)胞����、上皮細(xì)胞����、成纖維細(xì)胞等主要細(xì)胞類群及下屬的40個CD45+的免疫細(xì)胞類群和12個CD45-的非免疫細(xì)胞類群(圖1)。這些細(xì)胞亞群均具有特異性的表達(dá)特征����,且在不同組織中呈現(xiàn)出不同的細(xì)胞類型富集特征。
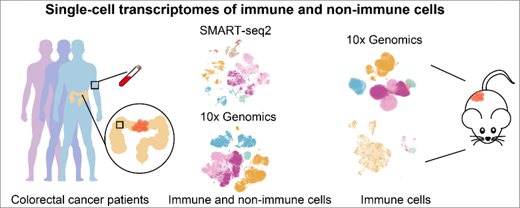
圖1 整合結(jié)直腸癌患者和小鼠模型的單細(xì)胞轉(zhuǎn)錄組研究思路
在對各細(xì)胞類群進行功能注釋后��,研究人員發(fā)現(xiàn)了一群富集于腫瘤內(nèi)的FCN1+的單核細(xì)胞樣細(xì)胞�����,并推測其可能是TAM細(xì)胞發(fā)育的前體,這與近期在小鼠模型上研究腸道組織巨噬細(xì)胞的發(fā)育模式相吻合【5】��。研究者還發(fā)現(xiàn)腫瘤相關(guān)巨噬細(xì)胞可以被分為SPP1+ TAM和C1QC+ TAM兩個具有不同發(fā)育來源 ����、不同細(xì)胞功能的細(xì)胞類群 (圖2)�。應(yīng)用RNA velocity等多種譜系發(fā)育分析推斷,C1QC+ TAM可能通過IL1B+的巨噬細(xì)胞發(fā)育而來��,發(fā)揮細(xì)胞吞噬和抗原呈遞的功能����;而SPP1+ TAM可能由NLRP3+的組織駐留巨噬細(xì)胞發(fā)育而來,發(fā)揮促血管生成及促進腫瘤轉(zhuǎn)移的功能���。值得注意的是���,結(jié)合腸炎病人及健康受試者的單細(xì)胞轉(zhuǎn)錄組數(shù)據(jù)【6】,研究人員首次分析發(fā)現(xiàn)���,SPP1+ TAM特異性地富集在結(jié)直腸癌病人癌組織中����,提示其可能在結(jié)直腸癌腫瘤發(fā)生發(fā)展中發(fā)揮重要作用。
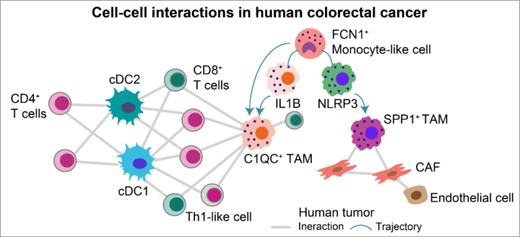
圖2 結(jié)直腸癌浸潤細(xì)胞亞型相互作用網(wǎng)絡(luò)及髓系免疫細(xì)胞發(fā)育路徑
2. 細(xì)胞間相互作用網(wǎng)絡(luò)提示結(jié)直腸癌髓系細(xì)胞的不同功能
為了研究結(jié)直腸癌內(nèi)各細(xì)胞類群間的相互作用關(guān)系����,研究人員利用Smart-seq2數(shù)據(jù)中各細(xì)胞類群的特征基因集及TCGA中結(jié)直腸癌的bulk樣本,對各細(xì)胞類群間的相關(guān)性進行了 計算����,并進而在癌旁組織和腫瘤內(nèi)構(gòu)建出“相關(guān)性關(guān)系網(wǎng)絡(luò)(Correlative network)”。從所構(gòu)建的細(xì)胞間相互作用網(wǎng)絡(luò)中可以發(fā)現(xiàn)����,TAM細(xì)胞和DC細(xì)胞與多的細(xì)胞類群發(fā)生相互作用,構(gòu)成了腫瘤內(nèi)相互作用網(wǎng)絡(luò)的核心節(jié)點 (圖2)���。值得注意的是�,SPP1+ TAM和C1QC+ TAM也具有不同的細(xì)胞間作用關(guān)系��,其中C1QC+ TAM主要與多種T細(xì)胞亞群發(fā)生相互作用�,SPP1+ TAM則主要與腫瘤相關(guān)成纖維細(xì)胞(Cancer-associated fibroblast,CAF)發(fā)生相互作用�,這也與上述這兩群細(xì)胞的主要功能相對應(yīng)。兩群經(jīng)典的DC細(xì)胞(Conventional DC,cDC)分別與不同類型的T細(xì)胞相互作用��。該研究中新建立的細(xì)胞間相互作用分析網(wǎng)絡(luò)���,有助于深入理解免疫細(xì)胞在腫瘤微環(huán)境中的不同功能�����。
3. 結(jié)直腸癌病人及小鼠腫瘤模型中浸潤的保守的免疫細(xì)胞亞型
基于以上針對結(jié)直腸癌腫瘤微環(huán)境的解析,研究人員接著利用小鼠腫瘤模型來研究靶向不同髓系細(xì)胞類群對抗腫瘤免疫反應(yīng)造成的影響�����。anti-CSF1R抑制劑和anti-CD40激動劑是兩種已進入前臨床實驗階段的靶向髓系細(xì)胞的免疫治療策略【7,8】��。其中CSF1R是促進髓系細(xì)胞增殖和分化的重要受體���,CD40則是TNF受體家族的成員�����,在DC細(xì)胞和T細(xì)胞間的信號傳遞中發(fā)揮重要功能����。研究者分別在MC38和Renca兩種小鼠模型中進行了anti-CD40與anti-CSF1R的治療,并獲得小鼠腫瘤浸潤免疫細(xì)胞單細(xì)胞轉(zhuǎn)錄組圖譜��。與以上結(jié)直腸癌病人相比����,DC和T細(xì)胞亞群在人和小鼠腫瘤中均有較高的一致性,如研究團隊此前發(fā)現(xiàn)的激活的LAMP3+ DC【9】和BHLHE40+ Th1-like 細(xì)胞【4】����。而盡管巨噬細(xì)胞在人鼠間的異質(zhì)性高于其他免疫細(xì)胞類群,但在小鼠腫瘤中也存在著與SPP1+ TAM和C1QC+ TAM相似的巨噬細(xì)胞亞群�。
4. 單細(xì)胞轉(zhuǎn)錄組揭示anti-CSF1R抑制劑作用機制
研究人員進而對治療前后各細(xì)胞亞群比例及轉(zhuǎn)錄組的變化進行了分析,發(fā)現(xiàn)不同TAM細(xì)胞亞群對anti-CSF1R治療的敏感程度不同 (圖3)���。Anti-CSF1R治療耐受的TAM細(xì)胞亞群與結(jié)直腸癌患者中的SPP1+ TAM具有較高的相似性���,且會特異性地高表達(dá)與促血管生成相關(guān)的基因Vegfa以及參與免疫抑制過程的基因Cd274和Arg1。Anti-CSF1R阻斷型抗體會影響處在細(xì)胞周期中的巨噬細(xì)胞的增殖����,并會特異性地刪除掉一定比例的具有C1QC+ TAM特征的巨噬細(xì)胞,卻不會對具有SPP1+ TAM特征的巨噬細(xì)胞起到作用����,提示anti-CSF1R治療后保留了在腫瘤中具有促進腫瘤血管生成的巨噬細(xì)胞。該研究對anti-CSF1R抑制劑在大部分腫瘤患者中單藥療效較差的原因給出了一個機制性解釋。
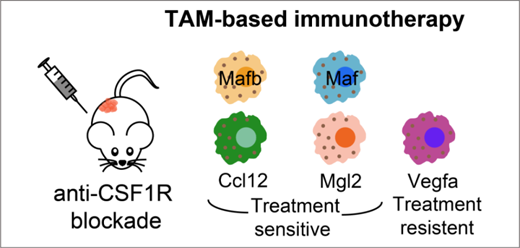
圖 3 靶向巨噬細(xì)胞的anti-CSF1R抑制劑作用機制
5. 單細(xì)胞轉(zhuǎn)錄組揭示anti-CD40抑制劑作用機制
Anti-CD40激動劑治療可以使MC38小鼠的腫瘤體積縮小��,且在與PD1阻斷劑聯(lián)合使用后還可以進一步抑制腫瘤的生長�����。然而��,Anti-CD40激動劑治療的機制及細(xì)胞亞群的變化有待深入闡釋�����。本研究結(jié)合結(jié)直腸癌腫瘤患者和小鼠模型單細(xì)胞轉(zhuǎn)錄組分析發(fā)現(xiàn)����,使用anti-CD40激動劑對MC38小鼠進行治療后的第2天����,激活態(tài)的Ccl22+ cDC1細(xì)胞即迅速做出響應(yīng),細(xì)胞比例顯著增加���。同時�����,在人鼠間保守的Bhlhe40+ Th1細(xì)胞比例也顯著上升 (圖4)���。使用研究組此前開發(fā)的針對T細(xì)胞及其克隆性的分析方法STARTRAC【4】����,研究人員發(fā)現(xiàn)anti-CD40激動劑治療后���,Bhlhe40+ Th1細(xì)胞的克隆增生顯著增強��。有意思的是���,Bhlhe40+ Th1細(xì)胞所表達(dá)的Cd40lg轉(zhuǎn)錄本比例在治療后也有顯著上升,提示著anti-CD40激動劑治療可以通過促進Bhlhe40+ Th1細(xì)胞表達(dá)更多的Cd40lg來進一步增強腫瘤中Bhlhe40+ Th1細(xì)胞與cDC1細(xì)胞間的相互作用����。
相比CD4+ T細(xì)胞,CD8+ T細(xì)胞的響應(yīng)速度則較慢�����,僅在治療后的第10天����,可以觀察到Ccl5+ Tem細(xì)胞和Cxcr6+ Trm細(xì)胞比例的顯著增加�����,值得注意的是���,Tem細(xì)胞在淋巴結(jié)和腫瘤間的遷移能力,及該群細(xì)胞與Trm細(xì)胞間的轉(zhuǎn)換能力也在治療后有著顯著的提升���,提示此群Tem細(xì)胞可能與Stem-like T細(xì)胞相似�����,具有補充池(Pool)的功能�。
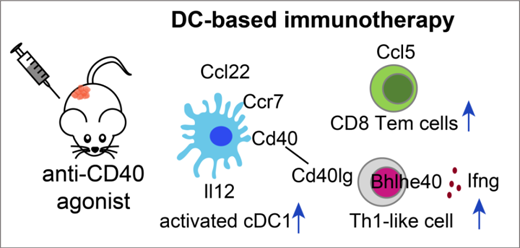
圖4 靶向DC細(xì)胞的anti-CD40激動劑作用機制
該研究共同一作者北京大學(xué)博士后張雷博士(同時為Nature工作共同一作者)表示����,“該工作對此前團隊針對結(jié)直腸癌腫瘤浸潤T細(xì)胞的研究有很好的延續(xù)性和前瞻性�。此前研究中發(fā)現(xiàn)MSI結(jié)直腸癌病人中會富集一群BHLHE40+ Th1-like細(xì)胞,認(rèn)為可能是該類型患者免疫治療響應(yīng)更好的原因之一����。而對于MSS病人的治療響應(yīng)仍缺乏認(rèn)識。在此項結(jié)合人鼠單細(xì)胞轉(zhuǎn)錄組的工作中�,團隊首次發(fā)現(xiàn)靶向DC的治療策略anti-CD40可以顯著地提高此類細(xì)胞的水平�,為MSS病人的臨床治療策略提供一定的指導(dǎo)����。而靶向TAM的藥物機制的研究,將大大有助于后續(xù)靶點的挖掘及新的治療策略的開發(fā)���?���!?/span>
據(jù)悉����,北大-清華生命科學(xué)聯(lián)合中心CLS博士后張雷博士,北京大學(xué)生命科學(xué)學(xué)院博士生李子逸����、Amgen公司Katarzyna M. Skrzypczynska博士為該論文的并列一作者,北京大學(xué)BIOPIC����,北京大學(xué)生命科學(xué)學(xué)院,ICG和CLS張澤民教授�、Amgen科學(xué)家Jackson G. Egen博士和Xin Yu博士以及北京大學(xué)人民醫(yī)院胃腸外科申占龍教授為該論文的共同通訊作者。Amgen炎癥與腫瘤免疫部負(fù)責(zé)人歐陽文軍博士對此研究提供了寶貴建議�����。

部分研究人員,從左到右:任仙文����,張啟明,李子逸(共同一作)���,歐陽文軍��,高染染���,張澤民(Lead通訊),張雷(共同一作)��,申占龍(共同通訊)����,房巧,胡學(xué)達(dá)
專家點評
葉幼瓊���、蘇冰(上海交通大學(xué)醫(yī)學(xué)院,上海市免疫學(xué)研究所)
腫瘤免疫療法�,例如免疫檢查點阻斷療法(Immune checkpoint blockade�����,ICB)����,使得實體瘤治療有了革命性進展���,顯著提高了許多惡性腫瘤患者的長期生存���。但并不是所有腫瘤都對免疫療法有響應(yīng),目前只有少部分腫瘤病人具有顯著療效�。因此臨床上迫切需要找到免疫治療響應(yīng)與否的具體機制以及相應(yīng)的生物標(biāo)記,以提高免疫療法的效果�。近年來,腫瘤微環(huán)境中的其它細(xì)胞成分�����,例如髓系細(xì)胞和其它免疫細(xì)胞亞群對腫瘤免疫治療效果的影響也逐漸受到人們重視���。CSF1R阻斷療法在多個癌種中可以抑制腫瘤相關(guān)巨噬細(xì)胞而增加CD8/CD4 T細(xì)胞的比例���。然而�,由于我們對腫瘤微環(huán)境復(fù)雜性的不完全了解���,髓系細(xì)胞靶定治療在腫瘤中的具體作用以及機制并沒有被完全理解���。
目前單細(xì)胞測序技術(shù)已經(jīng)成為探究細(xì)胞類群多樣性的有力手段,而不同的測序技術(shù)在細(xì)胞捕獲和基因捕獲效率上具有各自不同的優(yōu)勢�����。SMART-seq2測序技術(shù)利用孔板對單個細(xì)胞進行實驗�,通量雖相對較低,但每個細(xì)胞的基因捕獲率相對較高��;而10x Genomics測序技術(shù)利用基于微滴包被的原理����,可實現(xiàn)一次實驗獲得較多的細(xì)胞數(shù)量,有效降低了單細(xì)胞測序的實驗成本��。二者結(jié)合可以充分發(fā)揮不同數(shù)據(jù)類型的優(yōu)勢��,獲得高分辨率的單細(xì)胞圖譜以研究腫瘤微環(huán)境在免疫治療中的作用�。
4月16日,北京大學(xué)張澤民課題組結(jié)合SMART-seq2和10x Genomics兩種單細(xì)胞測序技術(shù),于Cell在線發(fā)表了題為“Single-Cell Analyses Inform Mechanisms of Myeloid-Targeted Therapies in Colon Cancer”的研究論文�����。通過分析腸癌病人的癌組織�����、癌旁組織和外周血的單細(xì)胞轉(zhuǎn)錄組�����,獲得高分辨率腸癌免疫細(xì)胞和非免疫細(xì)胞圖譜����。并揭示了單核細(xì)胞/巨噬細(xì)胞的組織特異性�����,以及主要髓系細(xì)胞亞群在小鼠和人中的保守性����。其中腫瘤相關(guān)巨噬細(xì)胞(TAM)主要來源于特異腫瘤浸潤的單核細(xì)胞樣細(xì)胞。區(qū)別于已知的M1和M2兩種巨噬細(xì)胞�,TAM呈現(xiàn)兩種不同狀態(tài),一種與炎癥相關(guān)(C1QC+ TAM),更傾向于和髓系細(xì)胞或T細(xì)胞相互作用���;另一種與腸癌轉(zhuǎn)移����、血管生成相關(guān)(SPP1+ TAM)����,更傾向于與腫瘤相關(guān)成纖維細(xì)胞或內(nèi)皮細(xì)胞相互作用。有意思的是���,在小鼠實驗中��,SPP1+ TAM對 CSF1R阻斷治療具有耐藥性���,同時結(jié)腸癌病人中具有高浸潤SPP1+ TAM和低浸潤C1QC+ TAM都會有較差的預(yù)后,說明CSF1R單藥治療并不能完全消除TAM的促進腫瘤作用���。其次作者確定腫瘤微環(huán)境中的三類樹突狀細(xì)胞(DC)��,包括LILRA4+ pDC����、BATF3+ cDC1和CD1C+ cDC2,其中人的BATF3+ cDC1和小鼠的Ccl22+ cDC1/Clec9a+ cDC1保守���,并意外發(fā)現(xiàn)BATF3+ cDC1同時和耗竭CD8 T細(xì)胞還有BHLHE40+ Th1樣細(xì)胞相互作用�����。在小鼠實驗中,作者發(fā)現(xiàn)CD40激動劑治療能增加Ccl22+ cDC1細(xì)胞亞群比例而對其它DC亞群影響很小����,并能同時增加效應(yīng)記憶T細(xì)胞數(shù)量而減少耗竭CD8 T細(xì)胞數(shù)量,誘導(dǎo)腫瘤中Bhlhe40+ Th1樣細(xì)胞的活化和擴增��。此研究也從單細(xì)胞層面解析了CD40激動劑作用機制�,為其和PD-1阻斷劑的聯(lián)合治療提供了理論基礎(chǔ)。
該工作全面地解析結(jié)腸癌的腫瘤微環(huán)境細(xì)胞圖譜�,闡明細(xì)胞與細(xì)胞之間的相互作用,以髓系細(xì)胞為靶標(biāo)的CSF1R阻斷劑和CD40激動劑的治療為例��,揭示髓系細(xì)胞靶定治療的相關(guān)機制�����,對靶向腫瘤免疫微環(huán)境為基礎(chǔ)的腫瘤治療提供了更詳細(xì)的理論基礎(chǔ)����,為今后靶定髓系細(xì)胞的精準(zhǔn)治療提供助力��,具有重要的臨床轉(zhuǎn)化意義����。針對該工作中CSF1R阻斷劑治療的耐受性���,未來研究需要尋找調(diào)控SPP1+ TAM的一系列因子�,設(shè)計合適抑制劑���,并通過聯(lián)合治療的方式達(dá)到完全消除TAM�����。同時需要推動基于髓系細(xì)胞的細(xì)胞療法的臨床實驗及相關(guān)生物學(xué)機制研究����,以其提高免疫治療療效���。
聲明:本文版權(quán)歸原作者所有����,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標(biāo)記有誤�,或侵犯您的版權(quán),請聯(lián)系我們���,我們將在及時修改或刪除內(nèi)容�,聯(lián)系郵箱:marketing@360worldcare.com




