治療特定肺癌患者�,武田EGFR抑制劑獲突破性療法認(rèn)定
武田(Takeda)公司宣布,美國FDA已授予其在研EGFR/HER2抑制劑mobocertinib(TAK-788)突破性療法認(rèn)定�,用于治療攜帶EGFR外顯子20插入(exon 20 insertions)突變的非小細(xì)胞肺癌(NSCLC)患者�����,這些患者在接受鉑基化療后疾病依然進展���。

肺癌是在中國和世界上導(dǎo)致癌癥死亡的首要原因之一。非小細(xì)胞肺癌常見的驅(qū)動突變是EGFR基因的改變�����,這是一種促進細(xì)胞生長和分裂的受體酪氨酸激酶�����。EGFR突變存在于10%到15%的非小細(xì)胞肺癌患者中���。攜帶EGFR外顯子20插入突變的患者僅占NSCLC患者的1%-2%�����。與其他EGFR突變相比����,這種疾病的預(yù)后更差,而且患者無法從免疫檢查點療法中獲益��。目前���,還沒有美國FDA批準(zhǔn)針對外顯子20突變的療法出現(xiàn)�����。
Mobocertinib是一種小分子酪氨酸激酶抑制劑(TKI)���,旨在選擇性靶向EGFR和HER2外顯子20插入突變。2019年���,美國FDA已授予mobocertinib孤兒藥資格����,治療攜帶EGFR突變或HER2突變(包括外顯子20插入突變)的肺癌患者�。
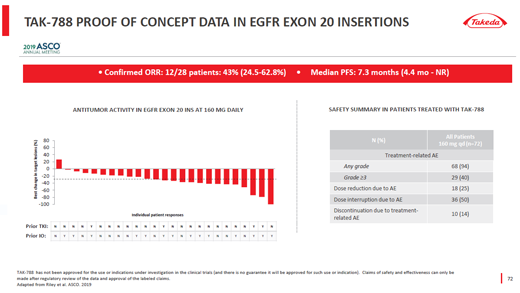
▲Mobocertinib(TAK-788)概念驗證試驗結(jié)果(圖片來源:武田官網(wǎng))
該項突破性療法認(rèn)定的授予是基于mobocertinib在一項1/2期臨床研究中取得的積極數(shù)據(jù)�。該研究旨在評估m(xù)obocertinib在治療攜帶EGFR外顯子20插入突變����,且既往接受過全身化療的局部晚期或轉(zhuǎn)移性NSCLC患者的療效與安全性。試驗數(shù)據(jù)表明�,mobocertinib的治療使患者的中位無進展生存期(PFS)達(dá)到7.3個月��,總緩解率(ORR)達(dá)到43%����。
“我們很高興FDA認(rèn)同mobocertinib治療EGFR外顯子20插入突變NSCLC患者的治療潛力,”武田腫瘤治療部門負(fù)責(zé)人Christopher Arendt博士說:“在武田�����,我們致力于開發(fā)難以治療疾病的新型藥物���。Mobocertinib的突破性療法認(rèn)定是我們努力優(yōu)化目前治療標(biāo)準(zhǔn)的重要一步��?���!?/span>
聲明:本文版權(quán)歸原作者所有�,轉(zhuǎn)載文章僅為傳播更多信息���,如作者信息標(biāo)記有誤,或侵犯您的版權(quán)����,請聯(lián)系我們,我們將在及時修改或刪除內(nèi)容�����,聯(lián)系郵箱:marketing@360worldcare.com

