基因編輯領(lǐng)域又迎來了一個重磅消息:昨日�����,四川大學(xué)華西醫(yī)院盧鈾教授團隊發(fā)布了世界一個CRISPR基因編輯臨床試驗的數(shù)據(jù)——證實使用CRISPR-Cas9編輯的T細胞在臨床上治療晚期肺癌等疾病�����,是安全可行的���。
他們在期刊《自然·醫(yī)學(xué)》報道了由CRISPR–Cas9 PD-1編輯的T細胞在晚期非小細胞肺癌患者中進行的首次人類I期臨床試驗的結(jié)果(ClinicalTrials.gov NCT02793856)。論文題為“Safety and feasibility of CRISPR-edited T cells in patients with refractory non-small-cell lung cancer”�。

研究人員們得出結(jié)論,CRISPR–Cas9基因編輯的T細胞的臨床應(yīng)用通常是安全可行的����。未來的試驗應(yīng)使用優(yōu)異的基因編輯方法來提高治療效果。
聚集有規(guī)律地間隔的CRISPR–Cas9編輯免疫檢查點基因�,可以提高T細胞療法的療效,但首要的任務(wù)是了解這種操作的安全性和可行性���,其次才是其功效����,探索性目標則包括跟蹤編輯的T細胞���。
這個試驗可以追溯到2016年6月——當時����,盧鈾教授團隊發(fā)起了世界一個CRISPR療法人體試驗,卻對CRISPR-Cas9在臨床應(yīng)用中的安全性仍存在諸多疑慮�。
而如今,CRISPR–Cas9基因編輯技術(shù)和癌癥免疫療法都獲得了巨大的飛躍����。用于阻斷PD-1/PD-L1通路的PD-1抑制劑,吸引了盧鈾教授團隊目光���。能否破壞T細胞的PD-1�,然后將T細胞回輸給患者���,從而實現(xiàn)晚期肺癌的治療����?
于是�,該團隊開始在久治無效的晚期肺癌患者身上展開了臨床研究,他們在經(jīng)過多種療法后不見成效��,并加入了這項研究成為志愿者��。,共有22例患者納入研究��。
在試驗過程中����,研究團隊使用Cas9和單向?qū)NA質(zhì)粒的電穿孔,通過共轉(zhuǎn)染離體生產(chǎn)PD-1編輯的T細胞��,從而破壞PD-1基因的2號外顯子����。
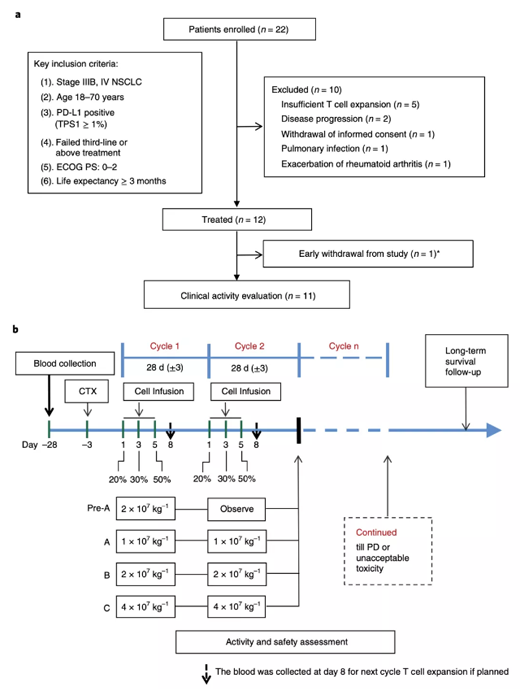
圖1:示意圖顯示了患者流程和研究設(shè)計�����,包括患者入組���、計劃的劑量組����、干預(yù)����、隨訪和結(jié)果評估。
試驗中,有5名患者因T細胞體外擴增不足���,沒有接受治療���,余下的17名患者均獲得了高活性(90%)的編輯后的T細胞。在回輸編輯過的T細胞之前����,有2人疾病進展,1人肺部感染��,1人類風濕關(guān)節(jié)炎加重����,1人主動退出研究。有12人接受了T細胞的回輸治療�����。
這12人在28天的周期內(nèi)�,分三次注射PD-1被編輯過的T細胞,每位患者每次回輸T細胞的中位數(shù)是1.33億個�。
從整體效果來看,基因編輯的效率在8.7%-31.2%之間����,中值是20.1%��。在編輯過的T細胞中����,PD-1的表達水平明顯降低��,PD-1的破壞率在33.7%-67%之間����,中值是46.3%。

圖2:T細胞中CRISPR–Cas9介導(dǎo)的PD-1基因編輯
所有與治療相關(guān)的不良事件均為1/2級��,這些不良事件包括淋巴細胞減少癥(3例)����、疲勞(3例)�����、白細胞減少癥(2例)�、發(fā)燒(2例)、關(guān)節(jié)痛(2例)和皮疹(2例)���。輸注后在外周血中可檢測到編輯過的T細胞�����。中位無進展生存期為7.7周(95%置信區(qū)間為6.9-8.5周)��,中位總生存期為42.6周(95%置信區(qū)間為10.3-74.9周)�����。通過下一代測序�����,在18個候選位點��,脫靶事件的中位突變頻率為0.05%(范圍為0-0.25%)��。
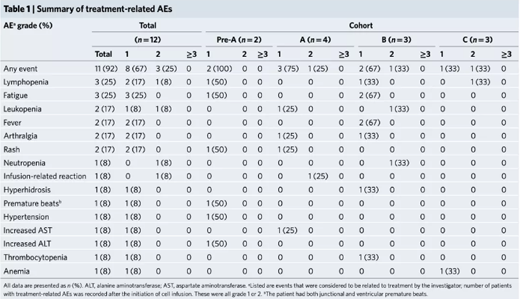
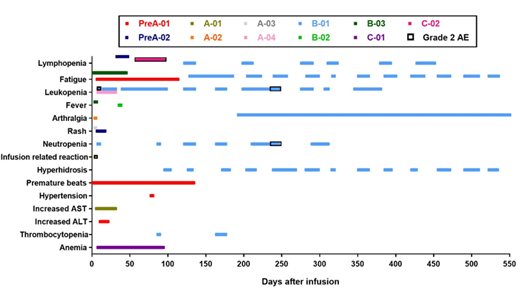
擴展數(shù)據(jù)圖2:與治療相關(guān)的不良事件及其持續(xù)時間�����。
他們的T細胞中位編輯效率是5.81%�����。與未被編輯的T細胞相比,在被編輯過的T細胞中�,CD8和IFN-γ雙陽性的占比顯著增加。這表明���,破壞T細胞的PD-1之后�����,T細胞的活性增強了�����。而另一方面����,中位脫靶率的結(jié)果為0.05%���,遠遠低于1.69%的中靶率——研究人員因此得出關(guān)于CRISPR-Cas9編輯T細胞這一操作安全性方面的結(jié)論。
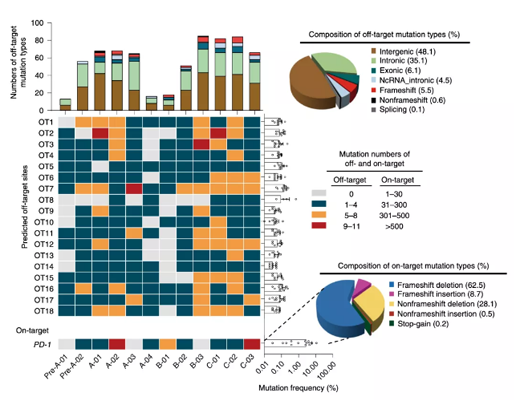
圖3:NGS和WGS進行的脫靶情況分析
截至2020年1月31日���,所有患者出現(xiàn)疾病進展��。在12名患者中����,有11名(91.7%)死于腫瘤進展,所有患者的死亡均與治療無關(guān)���。剩下的1名患者仍在接受其他治療��。
可以共享的任何數(shù)據(jù)和材料將通過材料轉(zhuǎn)讓協(xié)議發(fā)布�。支持該研究結(jié)果的所有其他數(shù)據(jù)將在可能的情況下由合理的要求由相應(yīng)的作者提供�。
該研究報告的原始測序數(shù)據(jù)已保存在中國科學(xué)院北京基因組研究所BIG數(shù)據(jù)中心的人類基因組序列檔案庫(http://bigd.big.ac.cn/gsa-human/)中。
聲明:本文版權(quán)歸原作者所有����,轉(zhuǎn)載文章僅為傳播更多信息,如作者信息標記有誤����,或侵犯您的版權(quán),請聯(lián)系我們����,我們將在及時修改或刪除內(nèi)容,聯(lián)系郵箱:marketing@360worldcare.com






